氯化钠和碳酸钠的混合物50克与一定量的氯化钙溶液恰好完全反应,产生20克沉淀,所得溶液中溶质的质量分数为20%.求:
(1)原混合物中碳酸钠的质量分数.
(2)氯化钙溶液中溶质的质量分数.
分析:氯化钠和碳酸钠的混合物中的碳酸钠可以与氯化钙反应生成碳酸钙沉淀和氯化钠,而混合物中的氯化钠不与氯化钙反应;因此恰好完全反应后,所得溶液为氯化钠溶液,其中氯化钠的质量有两部分:一部分为原混合物中的氯化钠,另一部分则来自反应生成的氯化钠;
根据反应的化学方程式,由生成沉淀的质量可计算原混合物中碳酸钠的质量及参加反应的氯化钙的质量、反应生成的氯化钠的质量;再利用质量守恒定律由反应所得溶液的质量求出加入的氯化钙溶液的质量.
解答:解:设原混合物中碳酸钠的质量为x,参加反应的氯化钙的质量为y,反应生成氯化钠的质量为z
Na
2CO
3+CaCl
2=CaCO
3↓+2NaCl
106 111 100 117
x y 20g z
= x=21.2g
= y=22.2g
= z=23.4g
原混合物中碳酸钠的质量分数=
×100%=42.4%
恰好完全反应后所得溶液的质量=
=261g
恰好完全反应时所加氯化钙溶液的质量=261g+20g-50g=231g
氯化钙溶液中溶质的质量分数=
×100%≈9.6%
答:(1)原混合物中碳酸钠的质量分数为42.4%;
(2)氯化钙溶液中溶质的质量分数约为9.6%.
点评:根据质量守恒定律,恰好完全反应后所得溶液质量=固体混合物的质量+所加氯化钙溶液的质量-生成沉淀的质量.



 (2011?南充)向下表中的甲物质中逐滴加入乙物质溶液至过量,反应生成气体或沉淀的质量与加入乙的质量关系符合如下曲线描述的是
(2011?南充)向下表中的甲物质中逐滴加入乙物质溶液至过量,反应生成气体或沉淀的质量与加入乙的质量关系符合如下曲线描述的是 向下表中的甲物质中逐滴加入乙物质溶液至过量,反应生成气体或沉淀的质量与加入乙的质量关系符合如下曲线描述的是( )
向下表中的甲物质中逐滴加入乙物质溶液至过量,反应生成气体或沉淀的质量与加入乙的质量关系符合如下曲线描述的是( )
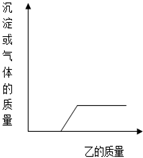 向如表中的甲物质中逐滴加入乙物质溶液至过量,反应生成气体或沉淀的质量与加入乙的质量关系符合如曲线图描述的是( )
向如表中的甲物质中逐滴加入乙物质溶液至过量,反应生成气体或沉淀的质量与加入乙的质量关系符合如曲线图描述的是( )