
 CO↑+CO2↑+H2O
CO↑+CO2↑+H2O
 3CO2+2Fe;
3CO2+2Fe; 3CO2+2Fe△m
3CO2+2Fe△m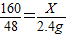
 ×100%=80%
×100%=80% 3CO2+2Fe;
3CO2+2Fe;

科目:初中化学 来源: 题型:
 某校化学课外兴趣小组的同学在研究性学习课上展示了一套如下图所示实验装置(假设每步化学反应都完全,氧化铁样品中的杂质不参加反应).查阅资料:草酸在浓硫酸存在时加热发生如下反应:H2C2O4
某校化学课外兴趣小组的同学在研究性学习课上展示了一套如下图所示实验装置(假设每步化学反应都完全,氧化铁样品中的杂质不参加反应).查阅资料:草酸在浓硫酸存在时加热发生如下反应:H2C2O4| 浓硫酸 | △ |
查看答案和解析>>
科目:初中化学 来源: 题型:
| ||
| △ |

| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
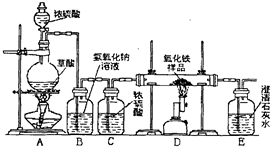 某校化学课外兴趣小组的同学在研究性学习课展示了一套如图所示的实验装置(假设每步化学反应都完全,氧化铁样品中的杂质不反应).查阅资料:草酸在浓硫酸存在时加热发生如下反应:
某校化学课外兴趣小组的同学在研究性学习课展示了一套如图所示的实验装置(假设每步化学反应都完全,氧化铁样品中的杂质不反应).查阅资料:草酸在浓硫酸存在时加热发生如下反应:
|
| ||
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com