

 ”原子,故说法正确;
”原子,故说法正确;

科目:初中化学 来源: 题型:
 26、日常用的干电池构造、组成如图1.某校化学活动小组进行的研究课题是《回收电池,变废为宝,保护环境》
26、日常用的干电池构造、组成如图1.某校化学活动小组进行的研究课题是《回收电池,变废为宝,保护环境》| 实验操作 | 实验现象 | 实验结论 |
| ①取样于试管中,滴入 氢氧化钠 溶液微热; |
①有 气体 产生; |
回收的物质中有NH4+ |
| ②将湿润的 红 色石蕊试纸放在试管口. |
②试纸变 蓝 . |
生成的气体是氨气 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 阴离子 阳离子 |
OH- | CO32- | HCO3- |
| Ca2+ | 微溶 | 不溶 | 可溶 |
| Mg2+ | 不溶 | 微溶 | 可溶 |
| 实验步骤 | 实验现象 | 结论 |
| 在少量研碎的水垢中,加入适量的蒸馏水充分搅拌,过滤,在滤液里加入Na2CO3溶液. | 没有白色沉淀产生 | 水垢中 不含Ca(OH)2 不含Ca(OH)2 . |
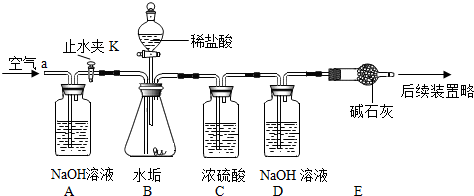
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
 某研究小组在实验室制取二氧化碳的研究中发现,通常不选用大理石与稀硫酸反应制取二氧化碳,其原因是反应生成硫酸钙微溶物覆盖在固体的表面,阻碍了大理石与稀硫酸的接触,应逐渐减慢甚至停止.
某研究小组在实验室制取二氧化碳的研究中发现,通常不选用大理石与稀硫酸反应制取二氧化碳,其原因是反应生成硫酸钙微溶物覆盖在固体的表面,阻碍了大理石与稀硫酸的接触,应逐渐减慢甚至停止.| 试管编号 | 1 | 2 | 3 | 4 | 5 |
| 硫酸浓度(%) | 15 | 20 | 25 | 30 | 35 |
| 气体体积( mL) | 35 | 47 | 55 | 51 | 42 |
| 试管编号 | A | B | C | D | E |
| 温度 (℃) | 40 | 50 | 60 | 70 | 80 |
| 现象和比较 | 有少量气泡 | 气泡比A号试管多 | 气泡明显比B试管多 | 大量气泡产生,与常温用盐酸反应相似 | 反应激烈,迅速产生大量气体 |
| 装置A | 装置B | |
| 长玻璃导管中现象 | 红墨水在长玻璃管中上升较快 红墨水在长玻璃管中上升较快 |
红墨水在长玻璃管中上升较慢 红墨水在长玻璃管中上升较慢 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
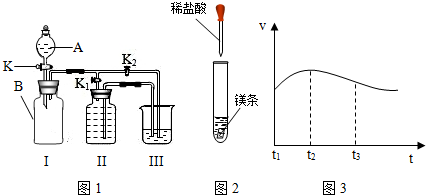
| ||
| ||
| 1 |
| 5 |
| 1 |
| 5 |
| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:
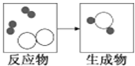 “见著知微”是化学学科的重要特点之一.如图是某化学反应的微观粒子示意图.
“见著知微”是化学学科的重要特点之一.如图是某化学反应的微观粒子示意图. B.两个
B.两个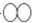 C.一个
C.一个 D.两个
D.两个
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com