
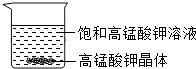
 如图所示,在烧杯中盛有常温下饱和的高锰酸钾溶液(烧杯中有晶体剩余),向其中加入一定量的水,保持温度不变,仅有部分晶体溶解,所得溶液与原溶液相比,说法正确的是( )
如图所示,在烧杯中盛有常温下饱和的高锰酸钾溶液(烧杯中有晶体剩余),向其中加入一定量的水,保持温度不变,仅有部分晶体溶解,所得溶液与原溶液相比,说法正确的是( )| A. | 溶质的质量增加,溶液颜色变深 | B. | 溶质溶解度不变,溶液颜色变浅 | ||
| C. | 溶质溶解度不变,溶液颜色不变 | D. | 溶剂质量增加,溶液颜色变浅 |
分析 根据溶解度的影响因素和溶液颜色的深浅与溶质质量分数有关考虑本题.
解答 解:A、加入一定量的水变成不饱和又溶解了一部分溶质,所以溶质质量增加,但溶液颜色是不变的,故A不正确;
B、加入水溶剂增多,但一开始溶液饱和,加入一定量的水,仅有部分晶体溶解,说明溶液仍然饱和,饱和溶液的质量分数与溶解度有关,因为温度不变所以溶解度不变,溶质质量分数也不变,所以溶液颜色不变,故B错误;
C、溶解度受温度影响,温度不变溶解度就不变,加入水溶剂增多,但一开始溶液饱和,加入一定量的水,仅有部分晶体溶解,说明溶液仍然饱和,饱和溶液的质量分数与溶解度有关,因为温度不变所以溶解度不变,溶质质量分数也不变,所以溶液颜色不变,故C正确;
D、溶解度受温度影响,温度不变溶解度就不变,加入水溶剂增多,但一开始溶液饱和,加入一定量的水,溶剂的质量增加;因为温度不变所以溶解度不变,溶质质量分数也不变,所以溶液颜色不变,故D错误.
故选C.
点评 本题关键是要知道溶解度的影响因素是温度,溶液颜色的深浅与溶液中溶质质量分数有关即溶液的浓度有关.


科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
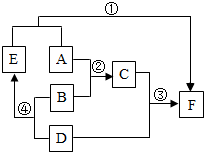 A、D均为黑色固体(D为常见金属)B为稀硫酸,D、E、F均为单质.如图为这些物质的转化关系,其中部分反应物、生成物、反应条件已省略.
A、D均为黑色固体(D为常见金属)B为稀硫酸,D、E、F均为单质.如图为这些物质的转化关系,其中部分反应物、生成物、反应条件已省略.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
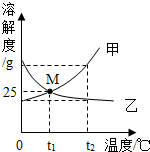 如图为甲、乙两物质(均不含结晶水)的溶解度曲线,下列说法错误的是( )
如图为甲、乙两物质(均不含结晶水)的溶解度曲线,下列说法错误的是( )| A. | 乙的饱和溶液由t2℃降温到t1℃时,溶质的质量分数不变 | |
| B. | 除去甲中含有的少量乙,可以用冷却热饱和溶液的方法 | |
| C. | t1℃时,50g水中分别加入25g的甲、乙,均可得到75g的饱和溶液 | |
| D. | t1℃时,等质量甲、乙两物质的饱和溶液蒸发等质量的水,所得溶液中溶质的质量一定相等 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
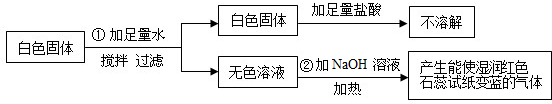
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 购物时用布袋代替塑料袋 | B. | 外出尽量步行或骑自行车 | ||
| C. | 充分利用太阳能 | D. | 直接燃烧煤炭 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
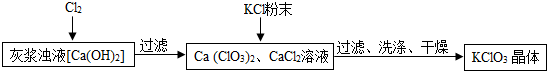
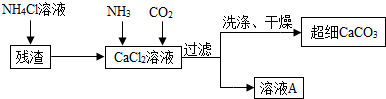
| 物质 | Ca(ClO3)2 | CaCl2 | KClO3 | KCl |
| 溶解度/g | 209.0 | 74.5 | 7.3 | 34.2 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com