考点:化石燃料及其综合利用,实验室制取氧气的反应原理,二氧化碳的实验室制法,二氧化碳的化学性质,物质发生化学变化时的能量变化,质量守恒定律及其应用,书写化学方程式、文字表达式、电离方程式,燃烧与燃烧的条件,常用燃料的使用与其对环境的影响
专题:综合实验题,化学与能源,化学用语和质量守恒定律
分析:(1)煤、石油和天然气属于化石燃料,是不可再生能源;
(2)汽油即可作燃料,又可以作有机溶剂;在化学反应中放出热量的方式有多种,如中和反应也可放热;人类利用能量有多种方式;增大可燃物与氧气或空气的接触面积,能够促进可燃物燃烧;
(3)此题根据质量守恒定律,反应前后原子种类和个数都不变,分别统计出反应前后原子种类及个数,比较分析就可以求出所得物质的化学式过氧化氢在(4)二氧化锰的催化作用下,分解能生成水和氧气;
可燃物与氧气接触,温度达到着火点时能够燃烧起来;
根据实验现象可以判断二氧化碳的物理性质、化学性质;
显酸性的溶液能使石蕊试液变红色,二氧化碳能和水反应生成碳酸
解答:解:(1)目前,人类利用的化石燃料主要包括煤、石油和天然气.
(2)A.汽油即可作燃料,又可以作有机溶剂,该选项叙述正确;
B.在化学反应中并不只有燃烧才能放出热量,如酸碱中和反应是放热反应,故错误;
C.人类利用的能量不都是通过化学反应获得的,例如人类利用的水能、风能、潮汐能等不是通过化学反应获得的,该选项叙述不正确;
D.将煤块粉碎是为了增大与空气的接触面积,能够使其燃烧充分,该选项叙述正确;
故填:AD.
(3)据质量守恒定律,反应前后原子种类和个数都不变,由方程式知生成物中含有的原子种类及原子个数为Ca,2;S,2;C,2;O,12;已知反应物中含有的原子种类及原子个数为S,2;O,6;比较分析可知X中含有Ca,C和O元素,其原子个数分别为1,1和3,故X的化学式为CaCO
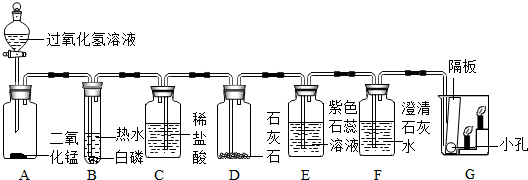
3(4).①由实验现象可知,A中生成的气体是氧气,过氧化氢在二氧化锰的催化作用下能够分解生成氧气,反应的化学方程式为:2H
2O
22H
2O+O
2↑.
②B中的白磷与氧气接触,温度达到了着火点,所以能够燃烧.
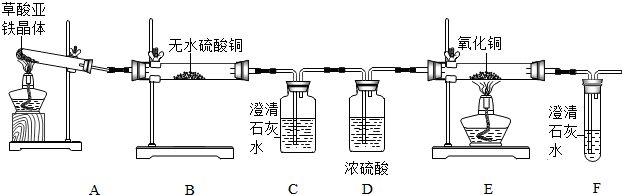
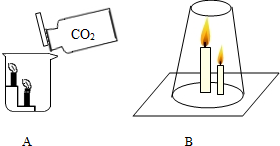
③石灰石和稀盐酸反应生成的二氧化碳最后进入G中后,由于二氧化碳的密度比空气大,不能燃烧,不支持燃烧,所以下层的蜡烛先熄灭.
④生成的二氧化碳进入E中后,二氧化碳能和其中的水反应生成碳酸,碳酸显酸性,能使石蕊试液变红色;
二氧化碳进入F中后,能和氢氧化钙反应生成碳酸钙沉淀和水,反应的化学方程式为:Ca(OH)
2+CO
2═CaCO
3↓+H
2O.
故答案为(1)石油 (2)AD (3)CaCO
3 (4)2H
2O
22H
2O+O
2↑.
与氧气接触,温度达到了着火点.下层;密度比空气大;不燃烧,不支持燃烧.故填:Ca(OH)
2+CO
2═CaCO
3↓+H
2O.
点评:化石燃料燃烧时能够产生大量污染环境的物质,并且日趋枯竭,因此开发利用新能源具有重要意义



 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案
 某校化学兴趣小组就空气中氧气的含量进行实验探究:
某校化学兴趣小组就空气中氧气的含量进行实验探究: