
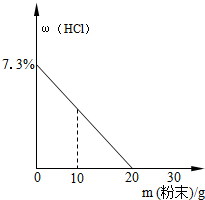
 将混合均匀的Na2CO3和NaCl的粉末混合物不断加入100g稀盐酸中,溶液中HCl溶质的质量分数与加入粉末混合物的变化曲线如图所示.求:
将混合均匀的Na2CO3和NaCl的粉末混合物不断加入100g稀盐酸中,溶液中HCl溶质的质量分数与加入粉末混合物的变化曲线如图所示.求:| 106 |
| x |
| 73 |
| 100g×7.3% |
| 117 |
| y |
| 44 |
| z |
| 10.6g |
| 20g |
| 20g-10.6g+11.7g |
| 100g+20g-4.4g |


科目:初中化学 来源: 题型:
 如图是某种加钙盐包装标签上的部分文字.回答:
如图是某种加钙盐包装标签上的部分文字.回答:查看答案和解析>>
科目:初中化学 来源: 题型:
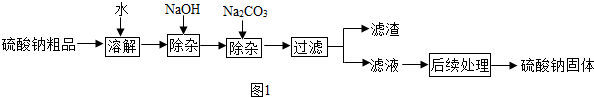
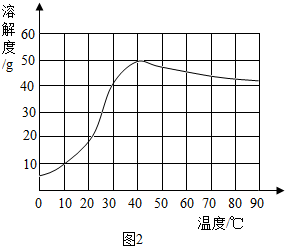
查看答案和解析>>
科目:初中化学 来源: 题型:
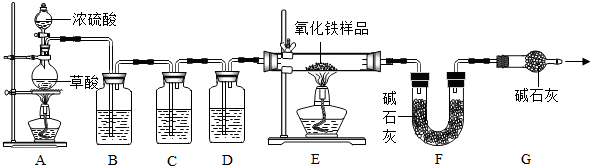
| ||
| △ |
查看答案和解析>>
科目:初中化学 来源: 题型:
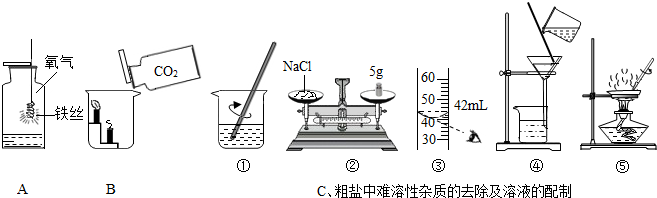
查看答案和解析>>
科目:初中化学 来源: 题型:
| 实验操作 | 预期现象与结论 |
查看答案和解析>>
科目:初中化学 来源: 题型:
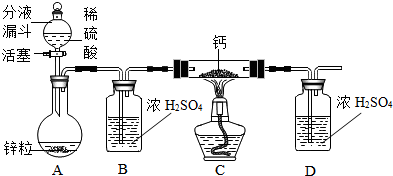
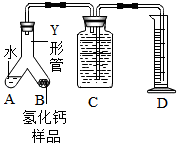
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com