
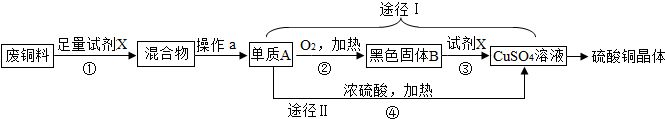
分析 (1)根据由废铜料(含铁)生产硫酸铜晶体进行分析;
(2)根据铜和氧气加热生成氧化铜,氧化铜和硫酸反应生成硫酸铜和水,途径II中产生二氧化硫气体不但会产生污染,而且会使部分硫酸因转化成二氧化硫而造成转化率不高进行分析;
(3)根据随着反应的进行,浓硫酸会逐渐变稀进行分析;
(4)根据随着反应的进行,浓硫酸会逐渐变稀,以及水的生成进行分析.
解答 解:(1)由废铜料(含铁)生产硫酸铜晶体,需要先将铁除去,所以试剂X的名称为硫酸;
(2)铜和氧气加热生成氧化铜,氧化铜和硫酸反应生成硫酸铜和水,所以②是2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO,③是CuO+H2SO4═CuSO4+H2O,途径II中产生二氧化硫气体不但会产生污染,而且会使部分硫酸因转化成二氧化硫而造成转化率不高,利用途径I制取硫酸铜的方案更合理;
(3)随着反应的进行,浓硫酸会逐渐变稀,所以生成SO2的质量会小于3.2克,故选:B;
(4)随着反应的进行,浓硫酸会逐渐变稀,以及水的生成,锌和稀硫酸反应生成氢气,理由是:浓硫酸反应一段时间后会变为稀硫酸后,不会再与Zn反应产生二氧化硫气体,而是反应生成氢气.
故答案为:(1)硫酸;
(2)②2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO,③CuO+H2SO4═CuSO4+H2O,I;
(3)B;
(4)氢气;浓硫酸反应一段时间后会变为稀硫酸后,不会再与Zn反应产生二氧化硫气体,而是反应生成氢气.
点评 根据生产流程图,正确理解每个过程在生产中的作用,从而达到全面掌握生产过程的目的,为解答问题做足准备.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ②④ | B. | ②③④⑥ | C. | ③④⑤ | D. | ①②④⑤ |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | HCl、NaOH、CuSO4、KCl | B. | KCl、AgNO3、HCl、HNO3 | ||
| C. | CuSO4、NaCl、KNO3、BaCl2 | D. | BaCl2、Na2SO4、Na2CO3、NaCl |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 物质(杂质) | 操作方式 |
| A | Cu(Fe) | 加足量稀硫酸,充分反应后过滤 |
| B | CO(CO2) | 将气体通入足量的澄清石灰水 |
| C | CO2(CO) | 点燃混合气体 |
| D | FeSO4溶液(CuSO4) | 加入足量铁屑,充分反应后过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
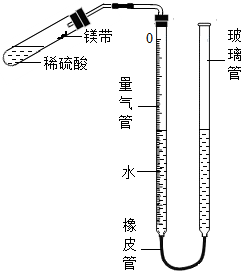 某课外活动小组同学用图装置(固定装置未画出)测定含有杂质的镁带中镁单质的质量分数(杂质与酸接触不产生气体).实验过程是:
某课外活动小组同学用图装置(固定装置未画出)测定含有杂质的镁带中镁单质的质量分数(杂质与酸接触不产生气体).实验过程是:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 石灰石 | B. | 纯碱 | C. | 熟石灰 | D. | 苛性钠 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com