
下图是初中化学常见的实验操作,其中正确的是( )

A. A B. B C. C D. D
C 【解析】A、氢气密度比空气小,应该用向下排空气法收集,错误;B、稀释浓硫酸时,要把浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌,以使热量及时地扩散;一定不能把水注入浓硫酸中,错误;C、检查装置气密性的方法:把导管的一端浸没在水里,双手紧贴容器外壁,若导管口有气泡冒出,装置不漏气,正确;D、用托盘天平称量时应该“左物右码”,验证质量守恒定律时,应在密闭容器中进行,错误。故选C。 ... 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源:吉林省德惠市2018届九年级下学期第一次月考化学试卷 题型:单选题
下列实验方案中,设计合理的是( )
A. 制取少量的氢氧化铜:将Ba(OH)2溶液和CuSO4溶液混合后过滤
B. 除去N2中混有的水蒸气和CO2:将气体依次通过浓硫酸、石灰水
C. 鉴别NaOH和NaCl:取等量样品,分别溶于适量水中,测温度变化
D. 检验氢氧化钠部分变质:取样,滴加适量的氢氧化钙溶液后,过滤,向滤液中再滴加酚酞溶液
C 【解析】A、Ba(OH)2溶液和CuSO4溶液混合后发生复分解反应生成氢氧化铜蓝色沉淀和硫酸钡白色沉淀,实验设计不合理,错误;B、除去N2中混有的水蒸气和CO2:将气体依次通过氢氧化钠、浓硫酸,实验设计不合理,错误;C、鉴别NaOH和NaCl:取等量样品,分别溶于适量水中,氢氧化钠溶于水放出热量,氯化钠溶于水温度无明显变化,故测温度变化鉴别,实验设计合理,正确;D、氢氧化钠和氢氧化钙均为...查看答案和解析>>
科目:初中化学 来源:重庆市2018届九年级下学期第一次月考化学试卷 题型:单选题
下列做法不正确的是( )
A. 服用含氢氧化铝的药物中和胃酸过多 B. 用洗洁精洗餐具上的油污
C. 用肥皂水检验硬水和软水 D. 用氢氧化钠改良酸性土壤
D 【解析】A、胃酸的主要成分是盐酸,故服用含氢氧化铝的药物与盐酸中和,治疗胃酸过多,正确; B、洗洁精具有乳化作用,能将大的油滴分散成细小的油滴随水冲走,可用于洗洁精洗餐具上的油污,正确;C、硬水和软水的区别在于所含的钙镁离子的多少,生活中可用肥皂水来区分硬水和软水,产生泡沫较多的是软水,较少的硬水,正确;D、氢氧化钠有强烈的腐蚀性,不适合改良酸性土壤,错误。查看答案和解析>>
科目:初中化学 来源:江西省赣州市心城区六校联盟2018届九年级下学期联考化学试卷 题型:综合题
走进生活,走进化学
(1)周末小雅妈妈用“加铁酱油”做了“红烧肉”,其中“加铁酱油”中的“铁”是指______(填“元素”或“原子”),炒菜完毕,关闭煤气罐阀门,燃着的煤气熄灭,其灭火的原理是______________; 饭后她用洗洁精清洗了餐具,这是利用了洗洁精的__________作用;
(2)家用净水器常用活性炭除去水中的一些杂质,利用了活性炭的___________性;
(3)用硬水洗衣服,既浪费肥皂也洗不干净衣服,生活中常用__________的方法降低水的硬度。
(4)洗漱时发现卫生间内铁质的置物架生锈了,铁生锈与______________有关,为了防止铁制品生锈,可采取的措施是____________________________(填一点)。
元素 清除可燃物(或隔离可燃物) 乳化 吸附 煮沸 水和氧气 刷油漆或制成不锈钢等 【解析】(1) “加铁酱油”中的“铁”是指元素;炒菜完毕,关闭煤气罐阀门,燃着的煤气熄灭,其灭火的原理是清除可燃物(或隔离可燃物);使用洗洁精轻松除去了碗碟上的油污,这是利用了洗洁精的乳化功能; (2)活性炭能吸附颜色和异味,家用净水器常用活性炭除去水中的一些杂质,利用了活性炭的吸附性;(3)硬水有很多危害,...查看答案和解析>>
科目:初中化学 来源:江西省赣州市心城区六校联盟2018届九年级下学期联考化学试卷 题型:单选题
下列四个图像中,能正确反映对应变化关系的是 ( )
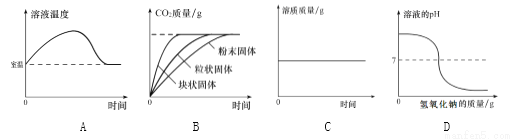
A. 硝酸铵溶于水时溶液的温度变化 B. 等质量碳酸钙与足量同浓度稀盐酸反应
C. 将浓硫酸加水稀释成稀硫酸 D. 向稀盐酸中不断滴加氢氧化钠溶液
C 【解析】A、硝酸铵溶于水时要吸收热量,溶液的温度降低,错误;B、等质量碳酸钙与足量同浓度稀盐酸反应,接触面积越大,反应越剧烈,故三者的反应率:粉末状>粒状>块状,错误;C、将浓硫酸加水稀释成稀硫酸,溶质质量不变,正确;D、向稀盐酸中不断滴加氢氧化钠溶液,溶液pH值应该从7以下开始上升,接近14,错误。故选C。查看答案和解析>>
科目:初中化学 来源:江苏省高邮市2018届九年级下学期第一次月考化学试卷 题型:综合题
工业废料石膏(CaSO4•2H2O)可以“变废为宝”,用于生产氧化钙、硫酸钾、电石(化学名称为碳化钙)等。某研究性学习小组展开了如下系列研究。
一、高纯CaO的制备
【资料一】
Ⅰ.石膏(CaSO4•2H2O)与碳粉高温煅烧生成氧化钙和几种气态非金属氧化物。
Ⅱ.SO2能使品红溶液褪色,也能使澄清石灰水变浑浊。
甲同学用如图1装置制备CaO并验证石膏与焦炭高温反应的其他产物。

实验过程中发现:B中无水硫酸铜变蓝;C中产生__现象证明有SO2生成;装置__中无明显变化和装置F中__现象证明有CO2生成。写出石膏与碳粉在高温条件下反应的化学方程式:____。
二、硫酸钾和电石的制备
乙同学模拟生产化肥硫酸钾和电石的流程如图2:

【资料二】CaO与C在高温下反应生成碳化钙(化学式为CaCx)和CO。
(1)反应①的化学方程式为___。证明固体M中不含CaCO3的方法是____(写出实验的方法、现象)。
(2)反应②的化学方程式为(NH4)2SO4+2KCl═K2SO4↓+2NH4Cl,该反应能析出K2SO4晶体的原因是__。
三、假设上述流程中制得的碳化钙(化学式为CaCx)固体中只含杂质CaO,乙小组同学为测定CaCx中x的值进行如下实验。

【资料三】CaCx在空气中灼烧生成CaO和CO2。
步骤一:称取3.76g样品于图3所示石英管中(测定装置图如图3,夹持及加热装置省略),反应前缓缓通入空气,高温灼烧石英管中的样品至反应完全后继续缓缓通入空气,测得丙溶液的质量比反应前增重了4.4g。(玻璃纤维可防止固体粉末进入导管)
步骤二:将石英管内剩余固体全部转移到水中,加入足量碳酸钠溶液,经搅拌、过滤、洗涤、干燥等操作得到碳酸钙固体6克。试回答下列问题:
(1)装置甲的作用是__。反应完全后继续缓缓通入空气的目的是__。
(2)根据步骤一、二计算该样品中钙、碳、氧的质量比为___,
计算确定CaCx的化学式(请写出计算过程)______________。
(3)若碳酸钙未能完全干燥,则会导致CaCX中的x的值____(填“偏大”、“偏小”、“无影响”)。
品红溶液褪色 E 出现浑浊 2CaSO4·2H2O + C 2CaO + CO2↑+ 2SO2↑+ 4H2O↑ CaSO4 + (NH4)2CO3 ===CaCO3↓+ (NH4)2SO4 取少量固体,加入稀盐酸,无气泡生成,则无碳酸钙 相同温度下,K2SO4的溶解度小 除去通入空气中的CO2气体 将生成的CO2完全排入丙装置中吸收 【答题空10】30:15:2 CaC2 偏小 【解析】一、...查看答案和解析>>
科目:初中化学 来源:江苏省高邮市2018届九年级下学期第一次月考化学试卷 题型:多选题
下列除杂设计(括号内为杂质)所选用试剂和操作都正确的是
序号 | 物质 | 选用试剂 | 主要操作 |
A | KNO3溶液(NaCl) | AgNO3溶液 | 过滤 |
B | MnO2(KCl) | H2O | 溶解、过滤 |
C | CaO(CaCO3) | —— | 高温煅烧 |
D | CO2(CO) | O2 | 点燃 |
A. A B. B C. C D. D
BC 【解析】A、NaCl能与AgNO3溶液反应生成氯化银沉淀和硝酸钠,再过滤,能除去杂质但引入了新的杂质硝酸钠,不符合除杂原则,故选项所采取的方法错误; B、KCl易溶于水,MnO2难溶于水,可采取加水溶解、过滤、洗涤、干燥的方法进行分离除杂,故选项所采取的方法正确; C、CaCO3高温煅烧生成氧化钙和二氧化碳,不但能把杂质除去,也会把原物质转化为氧化钙,符合除杂原则,故选项所...查看答案和解析>>
科目:初中化学 来源:江苏省高邮市2018届九年级下学期第一次月考化学试卷 题型:单选题
下列属于化学变化的是
A. 玻璃破碎 B. 品红扩散 C. 蜡烛燃烧 D. 干冰升华
C 【解析】A、玻璃破碎过程中只是形状发生改变,没有新物质生成,属于物理变化; B、品红扩散过程中只是状态发生改变,没有新物质生成,属于物理变化; C、蜡烛燃烧生成二氧化碳和水等新物质,属于化学变化; D、干冰升华过程中只是状态发生改变,没有新物质生成,属于物理变化。查看答案和解析>>
科目:初中化学 来源:山东省2018届九年级一模化学试卷 题型:科学探究题
海洋是人类的巨大资源宝库,试回答下列相关问题:
⑴海水淡化: 下图为太阳能海水淡化装置。

①该海水淡化过程,相当于实验室中的______(填“蒸发”或“蒸馏”)。
②下列分离混合物的常用方法中,原理与上述方法相同的是______(填序号)。
A.过滤法净化水 B.工业法制氧气 C.活性炭吸附
⑵海水制镁: 下图是由海水制备金属镁的工业流程:
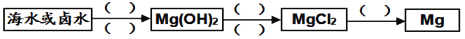
涉及的主要步骤有:①电解熔融的氯化镁 ②加石灰乳 ③加盐酸 ④过滤 ⑤蒸发结晶,其先后顺序正确的是(_______)。
A.②④③⑤① B.②④①⑤③ C.②③④⑤① D.③②④①⑤
⑶海水晒盐: 所得粗盐中常含有泥沙等难溶性杂质,可通过溶解、过滤、__________等操作去除。这样得到的食盐晶体中仍含有可溶性杂质CaCl2,工业上选用试剂______________对其进行除杂。
⑷海水制“碱”: 1926年,我国著名化学家___________创立了侯氏制碱法,以食盐为主要原料制取纯碱。生产过程中,先向饱和食盐水中通氨气,再通二氧化碳,涉及的反应原理如下:
NaCl + NH3 + CO2 + H2O ═ NaHCO3 + NH4Cl , 2NaHCO3 △ Na2CO3 + H2O + CO2↑
试回答下列问题:
①向饱和食盐水中先通氨气,再通二氧化碳的原因是________________。
②纯碱在生活生产中用途广泛。试写出工业上利用纯碱与熟石灰反应制取烧碱的化学方程式:______。
蒸馏 B A 蒸发结晶 碳酸钠 / Na2CO3(溶液) 侯德榜 氨盐水呈碱性且浓度大,更易吸收反应掉酸性气体CO2,提高产率。 Na2CO3 + Ca(OH)2 2NaOH + CaCO3↓ 【解析】(1)①该海水淡化过程,相当于实验室中的蒸馏;②A.过滤法净化水是将固体和液体分离的过程,不相同,错误; B.工业法制氧气是利用液氧和液氮的沸点不同将氧气和氮气分离,原理相同,正确; C.活性...查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com