
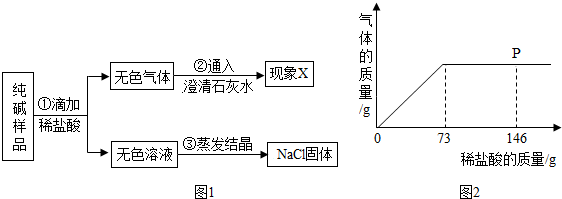
分析 (1)根据碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水进行分析;
(2)根据当滴入5%的稀盐酸至P点时,二氧化碳气体质量不再增加,所以此时盐酸过量烧杯中溶液里含有的溶质是氯化钠、氯化氢进行分析;
(3)根据过程③得到的氯化钠固体包括了碳酸钠和盐酸反应生成的氯化钠和原混合物中的氯化钠进行分析;
(4)根据碳酸钠和盐酸反应的化学方程式和参加反应的盐酸的质量进行计算.
解答 解:(1)碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水,所以图1中,过程②出现的现象为:石灰水变浑浊;
(2)当滴入5%的稀盐酸至P点时,二氧化碳气体质量不再增加,所以此时盐酸过量烧杯中溶液里含有的溶质是氯化钠、氯化氢;
(3)过程③得到的氯化钠固体包括了碳酸钠和盐酸反应生成的氯化钠和原混合物中的氯化钠,所以算出的结果与实际值比较将偏大;
(4)设参加反应的碳酸钠质量为x
Na2CO3+2HCl═2NaCl+CO2↑+H2O
106 73
x 73g×5%
$\frac{106}{x}$=$\frac{73}{73g×5%}$
x=5.3g
所以该样品中碳酸钠的质量分数为:$\frac{5.3g}{6g}$×100%=88.3%.
故答案为:(1)石灰水变浑浊;
(2)NaCl、HCl;
(3)偏大;
(4)该样品中碳酸钠的质量分数为:88.3%.
点评 本题主要考查根据化学方程式的计算,难度不大,需要首先搞清反应原理,然后结合题中所给的数据进行解答.


 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
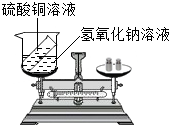 某兴趣小组为了验证质量守恒定律,在烧杯中盛有20g溶质质量分数为20%的氢氧化钠溶液试管内装有20g硫酸铜溶液,如图所示,放于天平上称量,此时天平平衡.然后将试管内药品倒入烧杯内(试管不取出),恰好完全反应,试根据要求,回答下列问题:
某兴趣小组为了验证质量守恒定律,在烧杯中盛有20g溶质质量分数为20%的氢氧化钠溶液试管内装有20g硫酸铜溶液,如图所示,放于天平上称量,此时天平平衡.然后将试管内药品倒入烧杯内(试管不取出),恰好完全反应,试根据要求,回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
| 溶解度 /g | KNO3 | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 |
| NaCl | 35.7 | 36 | 36.6 | 37.3 | 38.4 | 39.8 | |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 溶解是生活中常见的现象.
溶解是生活中常见的现象.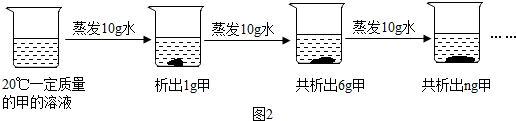
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
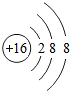 表示的粒子是S2-;
表示的粒子是S2-;查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 由相同元素组成的不同物质互为同素异形体 | |
| B. | 胆矾常常用于检验酒精中是否含有水 | |
| C. | 金属与酸溶液发生置换反应后,溶液的质量一定增加 | |
| D. | 某固体物质的饱和溶液一定比其不饱和溶液的溶质质量分数大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com