
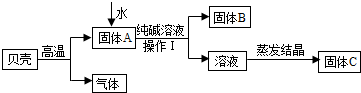
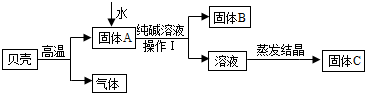
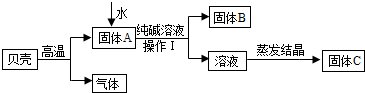
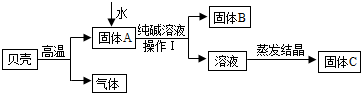
在古代,人们常用贝壳(主要成分是碳酸钙,杂质不参加反应且不溶于水)和纯碱为原料制取烧碱,某小组同学按图所示流程进行实验,请你参与讨论并回答相关问题.
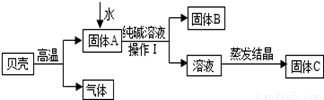
Ⅰ.定性研究
(1)生成固体B的化学反应方程式______________________________________________;
(2)操作Ⅰ指的是______________,其中要用到的玻璃仪器有烧杯、玻璃棒、 ;
(3)溶液蒸发结晶得到固体C的过程中,常用玻璃棒搅拌,其目的是__________________。
【猜想与假设】小组同学根据实验流程对所得的固体C的组成提出了质疑:甲同学认为:可能是NaOH、Na2CO3;乙同学认为: 可能是 ; 丙同学认为:可能是NaOH
【交流与评价】请你把乙同学的可能猜想结果写在横线上;
【活动与探究】甲同学取原溶液向其中倾倒一定量的稀盐酸观察到有大量气泡产生,于是得出该溶液中的溶质是NaOH、Na2CO3的结论,证实了自己的猜想。
乙同学取原溶液向其中加入Na2CO3溶液无现象,据此否定了自己的猜想;他又重新取原溶液,向其中加入____________观察到与甲同学不同的现象,得出了和甲同学相同的结论。
丙同学为了验证上述结论也取原溶液向其中滴加了少量稀盐酸,却发现无气泡产生。
【解释与结论】大家经过分析找出了丙同学所用试剂与甲同学相同,却没有看到气泡的原因。你认为可能的原因是 。经过上述三位同学的共同努力,大家终于对溶液中溶质的成分得出了正确结论。
Ⅱ.定量探究
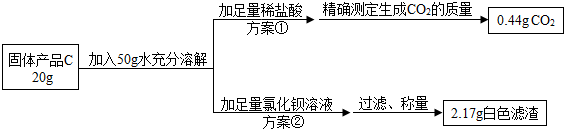
【提出问题】固体产品C氢氧化钠的质量分数是多少呢?
【设计实验】小组同学设计了两套不同的方案进行实验并测得数据如下:

请你利用方案①所得数据计算固体产品C中氢氧化钠的质量分数(请列出计算过程)
【实验反思】
另一组同学根据方案②所得数据计算出的氢氧化钠质量分数与方案①相比明显偏小,请你分析其中的可能原因:_________________________________。
Ⅰ.定性研究:
(1)Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;
(2)过滤,漏斗;
(3)使受热均匀,防止液滴飞溅;
【猜想与假设】NaOH和Ca(OH)2;
【活动与探究】适量CaCl2溶液或BaCl2溶液;
【解释与结论】少量稀盐酸先和NaOH反应无气泡。
Ⅱ.定量探究:
①94.7%
【实验反思】所得滤渣没有进行洗涤、干燥,使滤渣质量偏大,所求NaOH含量偏小
【解析】
试题分析:Ⅰ.定性研究:
(1)根据图示,碳酸钙高温煅烧,分解生成氧化钙(固体A)和二氧化碳, 其中氧化钙与水反应生成氢氧化钙,氢氧化钙再与碳酸钠溶液反应,生成碳酸钙沉淀(固体B)和氢氧化钠,故反应的化学方程式为Na2CO3+Ca(OH)2=CaCO3↓+2NaOH。
(2)由于操作Ⅰ是将固体B和溶液分离的措施,故为过滤,过滤要用到的玻璃仪器除了有烧杯、玻璃棒外,还需要漏斗(作为过滤器使用)。
(3)溶液蒸发结晶得到固体C的过程中,常用玻璃棒搅拌,目的是防止液体受热不均匀,液滴飞溅。
【猜想与假设】根据(1)的分析可知,氢氧化钙与碳酸钠溶液反应,生成碳酸钙沉淀和氢氧化钠,故固体C中一定含有反应生成的NaOH;而由于不能确定氢氧化钙与碳酸钠溶液是否恰好完全反应,故可能有三种情况:恰好完全反应只生成氢氧化钠(丙),碳酸钠有剩余(甲),氢氧化钙有剩余(乙),即可能是 NaOH和Ca(OH)2。
【活动与探究】根据题意,甲同学的猜想是正确的,即该溶液中的溶质是NaOH和Na2CO3,而根据上面的分析可知,溶液中是一定含有NaOH的,故乙同学只需验证溶液中是否含有Na2CO3即可,所以可取原溶液,向其中加入适量CaCl2溶液或BaCl2溶液,若可观察到有沉淀生成,则可得出和甲同学相同的结论。
【解释与结论】根据上面的分析可知,溶液中是一定含有NaOH,故若加入的稀盐酸的量较少,稀盐酸会先和NaOH反应,而没有和碳酸钠反应,故无气泡产生。
Ⅱ.定量探究:
①根据题意可知,稀硫酸与碳酸钠反应,生成硫酸钠、水和二氧化碳,故反应的化学方程式为H2SO4+ Na2CO3=Na2SO4+H2O+CO2↑,结合二氧化碳的质量,可求出参加反应的碳酸钠的质量,从而求出NaOH质量分数。
解,设20g固体C中含有碳酸钠的质量为x,
H2SO4+ Na2CO3=Na2SO4+H2O+CO2↑
106 44
x 0.44g
106:44= x:0.44g
解得,x=1.06g
则NaOH质量分数= 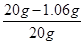 ×100%=94.7%
×100%=94.7%
【实验反思】根据题意可知,方案②是通过氯化钡与碳酸钠反应,生成碳酸钡沉淀,由沉淀的质量计算碳酸钠的质量,再进一步计算氢氧化钠的质量分数;由于通过所得数据计算出的氢氧化钠质量分数与方案①相比明显偏小,故说明碳酸钠质量偏大,则间接说明所得滤渣质量偏大,而造成这一结果的原因可能是,所得滤渣没有进行洗涤、干燥。
考点:物质的相互转化和制备
点评:对于探究型实验探究,要熟悉实验探究的环节和方法,精心设计实验方案,将所学过探究物质的性质或变化规律的技巧迁移至此,进行细心地探究实验和观察现象,再通过分析实验现象,推断、总结出该物质的性质或变化规律等。


科目:初中化学 来源: 题型:阅读理解
| ||
| ||
| 实验操作 | 现象 | 结论 | |
| 甲 | 取少量固体C,溶于适量水形成溶液后,滴加几滴酚酞试液 | 溶液变红 | 猜想成立 |
| 乙 | 取少量固体C,溶于适量水形成溶液后,滴加足量 稀盐酸(合理均可) 稀盐酸(合理均可) |
无气泡产生 | 猜想不成立 |
| 丙 | 取少量固体C,溶于适量水形成溶液后,滴加几滴饱和溶液 | 有白色沉淀产生 有白色沉淀产生 |
猜想成立 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解

| ||
| ||
| 实验操作 | 现象 | 结论 | |
| 甲 | 取少量固体C,溶于适量水形成溶液后,滴加几滴酚酞试液 | 溶液变红 | 猜想成立 |
| 乙 | 取少量固体C,溶于适量水形成溶液后,滴加足量的 稀盐酸 稀盐酸 |
无气泡产生 | 猜想不成立 |
| 丙 | 取少量固体C,溶于适量水形成溶液后,滴加几滴饱和Na2CO3溶液 | 生成白色沉淀 生成白色沉淀 |
猜想成立 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:
| 实验操作 | 现象 | 结论 | |
| 甲 | 取少量固体C,溶于适量水形成溶液后,滴加几滴酚酞试液 | 猜想成立 | |
| 乙 | 取少量固体C,溶于适量水形成溶液后,滴加足量 |
无气泡产生 | 猜想不成立 |
| 丙 | 取少量固体C,溶于适量水形成溶液后,滴加几滴饱和的 |
猜想成立 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com