
| 次数 | 加入稀硫酸的质量(g) | 反应后剩余的固体的质量(g) |
| 1 | 20 | 8.7 |
| 2 | 20 | m |
| 3 | 20 | 6.1 |
| 4 | 20 | 6.0 |
分析 (1)根据第三次加入稀硫酸后,固体减少0.1g,所以前两次加入的稀硫酸完全反应,所以m的值为:8.7g-(8.7g-6.1g)÷2=7.4g进行分析;
(2)根据金属锌完全反应时剩余固体铜的质量,计算样品中金属锌的质量,利用锌的质量与样品的质量比计算黄铜样品中锌的质量分数;
(3)根据第1次实验数据,由生成氢气的质量,根据反应的化学方程式,计算参加反应硫酸的质量,利用硫酸的质量与所加稀硫酸的质量比计算所用稀硫酸中硫酸的质量分数.
解答 解:(1)第三次加入稀硫酸后,固体减少0.1g,所以前两次加入的稀硫酸完全反应,所以m的值为:8.7g-(8.7g-6.1g)÷2=7.4g;
(2)黄铜样品中锌的质量分数为:$\frac{10g-6g}{10g}$×100%=40%;
(3)设所用稀硫酸中硫酸的质量分数为x,
H2SO4 +Zn═ZnSO4+H2↑
98 65
20g×x 10g-8.7g=1.3g
$\frac{98}{20g×x}$=$\frac{65}{1.3g}$
x=9.8%
答:所用稀硫酸中溶质的质量分数为9.8%.
故答案为:(1)7.4g;
(2)40%;
(3)9.8%.
点评 计算所用稀硫酸的溶质质量分数时,注意选取稀硫酸完全反应时的实验数据即前三次实验的数据进行计算.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | D>A>B>C | B. | A>C>B>D | C. | C>D>A>B | D. | B>D>C>A |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②③④ | C. | ①②③ | D. | ②③ |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题


查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
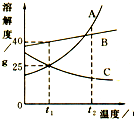 小明同学绘制了A、B、C三种固体物质的溶解度曲线如图.
小明同学绘制了A、B、C三种固体物质的溶解度曲线如图.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 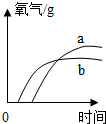 | B. | 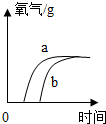 | C. | 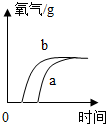 | D. |  |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com