
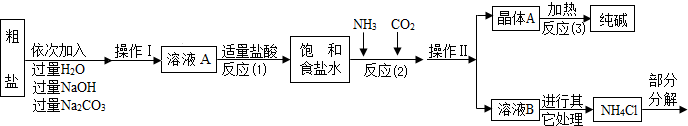
(1)如图所示,某混合气体含有初中化学常见的气体,将其依次通过装有澄清的石灰水的甲乙两个试剂瓶,甲无明显现象,乙中的澄清的石灰水变浑浊。则该气体的成分为___▲___;甲中发生反应的化学方程式为___▲___。

|
|
A |
B |
C |
D |
|
A |
- |
- |
↓ |
- |
|
B |
- |
- |
↑ |
- |
|
C |
↓ |
↑ |
— |
- |
|
D |
- |
- |
- |
- |
(2)现有稀盐酸、石灰水、食盐水、碳酸钠溶液四种无色溶液,为鉴别它们分别编号为A、B、C、D,然后各取少许进行两两混合实验,现象见右表(图中“↓”“↑”“-”符号分别表示生成沉淀、气体和无明显变化)。根据表中实验现象判断
①B为___▲___(填化学式);
②A与C发生反应的化学方程式为___▲___,该反应的基本反应类型是___▲___。
(3)某课外学习小组用碳酸钠溶液分别鉴别澄清石灰水与盐酸。实验后将废液倒入同一烧杯中,最后烧杯内液体澄清。老师引导课外小组的同学讨论分析后认为,烧杯中澄清的溶液可能会含有下列物质:Na2CO3、HCl、Ca(OH)2、NaOH、NaCl、CaCl2,请你根据初三化学所学知识判断:该烧杯澄清溶液中一定含有的溶质是___▲___,一定不含有的溶质是___▲___。
 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:阅读理解
| ||
| ||
| ||
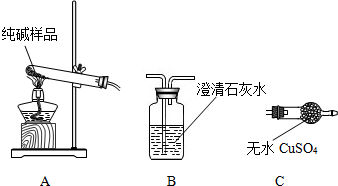
| 选择的装置 | 实验现象 | 实验结论 |
AB”或“AC”或“ACB AB”或“AC”或“ACB |
“B不变浑浊”或“C不变蓝”或“C不变蓝、B不变浑” “B不变浑浊”或“C不变蓝”或“C不变蓝、B不变浑” |
样品不含晶体A |
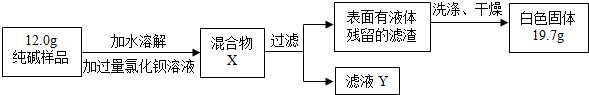
| 106 |
| X |
| 197 |
| 19.7g |
| 10.6g |
| 12.0g |
| 106 |
| X |
| 197 |
| 19.7g |
| 10.6g |
| 12.0g |
查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源:2011-2012学年安徽省六安市霍邱县石庙中学八年级(下)第一次月考化学试卷(解析版) 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:
如图所示,某学生用装置甲(瓶内避附有碳酸钙)作为制取氢气装置,先在瓶内放入锌粒,然后误将浓盐酸通过长颈斗注入瓶内中。现要有乙、丙、丁装置验证并除去 混有的杂质(H2O不需要验证),而得到纯净、干燥的氢气。请回答:
(1)写出甲装置中发生反应的化学方程式是 。
⑵乙装置中中盛装的试剂是 ,其作用是 ,反应的方程式是 。
⑶丙装置中中盛装的试剂是 ,其作用是 ,反应的方程式是 。
⑷丁装置中中盛装的试剂是 ,其作用是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com