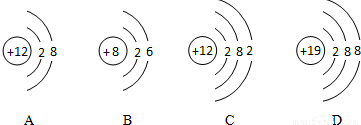
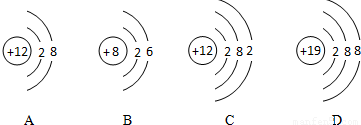
解:(1)在给出的氧、钾、镁三种元素中,其中钾、镁为金属元素,氧元素为非金属元素,根据相对原子质量≈质子数+中子数,核电荷数=核内质子数=核外电子数=原子序数,可知钾元素的原子序数为19,,所以质子数为19,相对原子质量为39,所以每个钾原子中的中子数为39-19=20.
所以答案为:金属;20.
(2)同种元素的粒子具有相同的核内质子数,A和C核内质子数相同,故A与C属于同种元素的粒子;核内质子数>核外电子数,则形成阳离子,故选A和D;8号元素为氧,19号元素为钾,氧原子最外层有6个电子,易得到2个电子形成8电子稳定结构,所以在形成化合物时显-2价;而钾原子的最外层有1个电子,在发生化学变化时易失去1个电子而显示+1价,根据化学式的书写原则,正价在前,负价在后,所以氧化钾的化学式为K2O.
故本题答案为:A和C;A和D;K2O.
分析:明确元素周期表中各元素的有关信息,如原子序数,相对原子质量及相对原子质量与质子数和中子数的相对关系,原子的结构示意图及其意义,以及原子和离子之间的转化,了解元素的简单分类方法,根据核外最外层电子数,若最外层电子数≥4,则一般为非金属元素,若最外层电子数<4,则一般为金属元素.掌握相关的规律:如在原子中,核电荷数=核内质子数=核外电子数,在离子中,有阳离子,核内质子数>核外电子数,阴离子中,核内质子数<核外电子数;相对原子质量在数值上约等于质子数+中子数;质子数相同则属于同种元素形成的粒子,并能根据原子结构示意图推测其在形成化合物时的化合价态.
点评:本题综合性较强,从元素周期表到原子结构示意图,考查学生对它们的理解和应用能力,包含的知识点也较多,如金属元素的判断;利用质子数和中子数、相对原子质量间的关系计算原子中的中子数,同种元素形成的粒子的特点、阴阳离子与化合价间的关系,化学式的书写等,不错的一道题.





 阅读快车系列答案
阅读快车系列答案