
| Zn(OH)2 | Fe(OH)2 | Mg(OH)2 | |
| 开始沉淀的pH | 5.7 | 7.6 | 10.4 |
| 沉淀完全的pH | 8.0 | 9.6 | 12.4 |
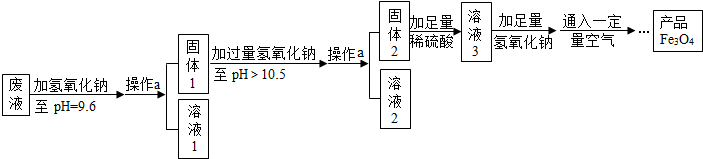
分析 (1)加入氢氧化钠溶液后,可以判断能形成得到氢氧化锌和氢氧化亚铁沉淀,可以据此写出反应的化学方程式;
(2)加入氢氧化钠后,硫酸锌和氢氧化钠反应生成了硫酸钠,氢氧化镁只有在pH值等于10.4时,才会沉淀,所以溶液中还含有硫酸镁,向固体1中加入氢氧化钠溶液,根据题给信息可以知道25℃时,Zn(OH)2可溶于pH>10.5的碱溶液,所以氢氧化锌要溶解,剩余的固体2为氢氧化亚铁,所以加入稀硫酸后溶液3的溶质为硫酸亚铁,可以据此解答该题;
(3)根据铁元素的质量守恒来完成该题的解答.
解答 解:(1)加入氢氧化钠溶液后,可以判断能形成得到氢氧化锌和氢氧化亚铁沉淀,该反应的化学方程式为:2NaOH+ZnSO4═Zn(OH)2↓+Na2SO4【或2NaOH+FeSO4=Fe(OH)2↓+Na2SO4】;故填:2NaOH+ZnSO4═Zn(OH)2↓+Na2SO4【或2NaOH+FeSO4═Fe(OH)2↓+Na2SO4】;
(2)加入氢氧化钠后,硫酸锌和氢氧化钠反应生成了硫酸钠,氢氧化镁只有在pH值等于10.4时,才会沉淀,所以溶液中还含有硫酸镁,向固体1中加入氢氧化钠溶液,根据题给信息可以知道25℃时,Zn(OH)2可溶于pH>10.5的碱溶液,所以氢氧化锌要溶解,剩余的固体2为氢氧化亚铁,所以加入稀硫酸后溶液3的溶质为硫酸亚铁;故填:硫酸镁、硫酸钠;硫酸亚铁;
(3)2.32g四氧化三铁中铁元素的质量为:2.32g×$\frac{56×3}{56×3+16×4}$=1.68g;
所以硫酸亚铁的质量为:1.68g÷$\frac{56}{56+32+16×4}$=4.56g
所以原废液中硫酸亚铁溶质的质量分数为$\frac{4.56g}{100g}$×100%=4.56%
答:原废液中硫酸亚铁溶质的质量分数不低于4.56%.
点评 要想解答好这类题目,首先,要理解和熟记物质的相互转化和制备方法,以及与之相关的知识.然后,根据所给的实验、问题情景,结合所学的相关知识和技能,以及自己的生产或生活经验所得,细致地分析题意,并细心地探究、推理后,按照题目要求进行认真地选择或解答即可.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | (1)属于吸热反应 | B. | (3)属于置换反应 | C. | (3)属于放热反应 | D. | (4)属于复分解反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| 步骤 | 操作 | 现象 | 分析与结论 |
| ① | 分别向盛有NaOH溶液、KOH溶液的A,B两试管中加入CuSO4溶液. | 两支试管均有蓝色沉淀生成 | 不同的碱溶液都含有OH-(填化学符号)所以不同的碱都有相似的化学性质. |
| ② | 用玻璃棒分别蘸取稀硫酸和浓硫酸于白纸A,B上,片刻. | 白纸A没明显现象;白纸B变黑(生成黑色的炭) | 同种酸,由于浓度不同,它们性质不完全相同 |
| 步骤 | 操作 | 现象 | 结论 |
| ① | 取适量固体于试管中加热,用一干冷玻片置于试管口上方. | 玻璃片上有小水珠 | 固体中含有H2O |
| ② | 取适量固体于试管中,加入足量的稀盐酸,观察溶液颜色. | 溶液呈黄色 | 固体中含有Fe2O3 |
| ③ | 收集步骤②试管中产生的气体,点燃. | 有爆鸣声 | 固体中含有Fe(填化学式) |
| ④ | 将上面反应后的混合液过滤. | 有黑色固体 | 黑色固体的主要成份 是C(填化学式) |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 天然淡水经沉降、过滤、吸附、灭菌等净化操作后,可供人们生活用水 | |
| B. | 用肥皂水可以区别软水和硬水,软水就是纯净水 | |
| C. | 水是常用的溶剂,能溶解所有物质 | |
| D. | 为了节约用水,提倡用工业废水直接灌溉农田 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com