



 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:阅读理解

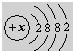 该元素在上表中位于
该元素在上表中位于查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解

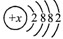 所示,则该元素的原子序数为
所示,则该元素的原子序数为查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:

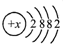 则该元素的原子序数为
则该元素的原子序数为查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
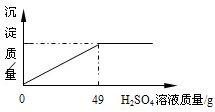 现有一瓶未开启的浓硫酸,试剂瓶标签上的部分内容如图所示.请根据有关信息回答并计算:
现有一瓶未开启的浓硫酸,试剂瓶标签上的部分内容如图所示.请根据有关信息回答并计算:| 硫酸(500mL) 品 名 硫酸 化学式 H2SO4 相对分子质量98 密 度 1.84g/cm3 质量分数98% (1)硫酸由 氢 氢 元素、硫 硫 元素、氧 氧 元素组成,它含氧元素,它不是 不是 (是、不是)氧化物;磷酸相对分子质量为98 98 ;你认为硫酸与磷酸含氧元素质量相等的条件是硫酸和磷酸的质量相等 硫酸和磷酸的质量相等 ;(2)该试剂瓶中硫酸溶液的质量是 920 920 g.(3)工会主席王赐用20g该浓硫酸配制20%的稀硫酸,以清洗钢铁表面的铁锈.他在配制该溶液时所用98%的浓硫酸与水的质量比应该为 10:39 10:39 .(4)某固体物质由氯化钠和氯化钡组成,取32.8g该固体混合物完全溶于水,并逐滴加入上述20%的稀硫酸,产生沉淀的质量与加入稀硫酸的质量有如图所示关系,计算32.8g固体混合物中氯化钠和氯化钡的质量. (5)若加入的稀硫酸刚好使沉淀达最大量时,将所得混合物过滤、洗涤,得滤液并将其稀释至200g(过程中损耗忽略不计),计算该滤液中溶质的质量分数为 氯化钠的质量分数为6%,氯化氢的质量分数为3.65% 氯化钠的质量分数为6%,氯化氢的质量分数为3.65% .(若溶液中含有多种溶质,则每种溶质的质量分数为该溶质的质量与溶液总质量之比)[注:(3)、(4)两问需写出计算过程].(6)喜欢探究又善于思考的周泽坤出这样题目考大家:把30g含Fe、Al、Mg、Zn的金属粉末投入适量的稀硫酸中全部溶解完,再将溶液蒸干得无水干燥固体126g,则同时产生的氢气质量为 2 2 g;探究中泽坤发现:用相同浓度的硫酸,与一瓶未变质、部分变质、全变质(杂质都是氢氧化钙)的生石灰样品反应,需要的硫酸质量都相等,其原因是氧化钙和碳酸钙都是每40g钙元素生成136g硫酸钙,消耗98g硫酸 氧化钙和碳酸钙都是每40g钙元素生成136g硫酸钙,消耗98g硫酸 .
查看答案和解析>> 同步练习册答案 湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区 违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com版权声明:本站所有文章,图片来源于网络,著作权及版权归原作者所有,转载无意侵犯版权,如有侵权,请作者速来函告知,我们将尽快处理,联系qq:3310059649。 ICP备案序号: 沪ICP备07509807号-10 鄂公网安备42018502000812号 |