
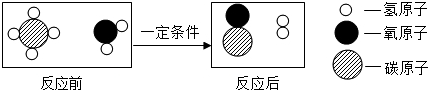
| A. | 反应前后分子的种类发生改变 | |
| B. | 水煤气的成分是一氧化碳和氢气 | |
| C. | 该反应中含氢元素的化合物有2种 | |
| D. | 该反应中甲烷和氢气的计量数之比为1:1 |
分析 根据反应的微观示意图分析,反应物是甲烷和水,生成物是一氧化碳和氢气,反应的化学方程式为CH4+H2O $\frac{\underline{\;一定条件\;}}{\;}$CO+3H2,据此分析解答即可.
解答 解:由图示可知,该反应的反应物是甲烷和水,生成物是一氧化碳和氢气,反应的化学方程式为:CH4+H2O $\frac{\underline{\;一定条件\;}}{\;}$CO+3H2.
A、由微粒的变化可知,反应前后分子的种类发生改变,故正确;
B、水煤气的成分是一氧化碳和氢气,故正确.
C、由上述方程式可知,该反应中含氢元素的化合物有2种,故正确;
D、该反应中甲烷和氢气的计量数之比为1:3,故错.
故选D.
点评 本题主要考查了化学反应中微观粒子方面的知识,明确每个模型表示的含义,这是解决这类题目的关键.


科目:初中化学 来源: 题型:选择题
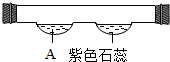 明磊同学在学习了微粒是不停运动的这一性质后,设计了如图装置,一段时间后,可观察到的紫色石蕊变红,则物质A是( )
明磊同学在学习了微粒是不停运动的这一性质后,设计了如图装置,一段时间后,可观察到的紫色石蕊变红,则物质A是( )| A. | 浓硫酸 | B. | 浓氨水 | C. | 生石灰 | D. | 浓盐酸 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | N2 | B. | N2H4 | C. | N2O4 | D. | H2O |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 结合图中KNO3和NaCl的溶解度曲线回答下列问题.
结合图中KNO3和NaCl的溶解度曲线回答下列问题.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | Na2SeO3中钠、硒、氧元素的质量比为2:1:3 | |
| B. | Na2SeO3属于盐类 | |
| C. | 硒是人体必须微量元素,尽可能多吃含硒的营养补剂 | |
| D. | Na2SeO3中Se显+2价 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 加入熟石灰并研磨,可区分氯化铵和硫酸铵 | |
| B. | 在靠近蜡烛火焰的上方放一只冷碟子,一段时间后可收集到炭黑 | |
| C. | 用灼烧并闻气味的方法,可区分羊毛纤维和棉纤维 | |
| D. | 在制作叶脉书签时,一般选用10%的氢氧化钠溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 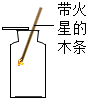 观察木条是否复燃,检验是否为氧气 | |
| B. | 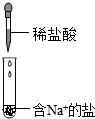 观察反应是否有气泡产生,判断是否为碳酸钠 | |
| C. |  观察呈现的不同现象,说明物质的溶解性与溶剂种类有关 | |
| D. | 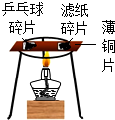 观察燃烧先后顺序,比较两种可燃物的着火点高低 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com