
| A. | 氟利昂 | B. | 臭氧 | C. | 甲烷 | D. | 二氧化碳 |
科目:初中化学 来源: 题型:解答题
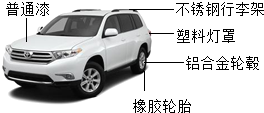 随着社会的发展,大力发展新能源汽车已成为趋势.安庆市新能源汽车项目预计2016年6月建成投产,建成后可实现年产5万辆电动汽车.
随着社会的发展,大力发展新能源汽车已成为趋势.安庆市新能源汽车项目预计2016年6月建成投产,建成后可实现年产5万辆电动汽车.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 序号 | ① | ② | ③ | ④ | ⑤ |
| 名 称 | 食 醋 | 白 酒 | 白糖水 | 石灰水 | 纯碱溶液 |
| 主要成分 | CH3COOH | C2H5OH | C12H22O11 | Ca(OH)2 | Na2CO3 |
| 溶液pH | 3 | 7 | 7 | 11 | 8 |
查看答案和解析>>
科目:初中化学 来源: 题型:多选题
| 物质 | 丙烷 | 氧气 | 水 | 二氧化碳 | X |
| 反应前质量/g | 4.4 | 12.8 | 0 | 0 | 0 |
| 反应后质量/g | 0 | 0 | 7.2 | 4.4 | a |
| A. | 表中a的值为5.6 | B. | 该反应为氧化反应 | ||
| C. | 不能判断X的元素组成 | D. | X可能是该反应的催化剂 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 地壳中含量最多的金属元素的原子结构示意图 | 2个铵根离子 | 相对分子质量为100的化合物 | 保持氧气化学性质的微粒 |
 | 2NH4+ | CaCO3 | O2 |
| ①实验室用暗紫色固体制氧气 | 2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑ |
| ②乙醇在空气中完全燃烧 | C2H5OH+3O2$\frac{\underline{\;点燃\;}}{\;}$2CO+3H2O |
| ③有单质铁生成的置换反应 | 2Fe2O3+3C$\frac{\underline{\;点燃\;}}{\;}$4Fe+3CO2↑; |
| ④有大量的热放出的化合反应 | CaO+H2O═Ca(OH)2 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验操作 | 实验现象 | 实验结论 |
| 取一定量纯碱样品配成溶液后,滴加过量的CaCl2溶液. | 产生白色沉淀 | 反应的化学方程式: Na2CO3+CaCl2═CaCO3↓+2NaCl |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com