
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 青菜 | B. | 豆浆 | C. | 牛奶 | D. | 鸭肉 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 木炭在氧气中燃烧,发出白光,生成无色气体 | |
| B. | 向Na2CO3溶液中滴加澄清的石灰水,有白色沉淀产生 | |
| C. | CO还原Fe2O3的实验后,玻璃管中的粉末由红棕色变成黑色 | |
| D. | 用石蕊溶液染成的干燥的纸花放入CO2集气瓶中,纸花变红色 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
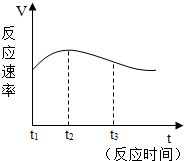 小民同学在练习“金属的化学性质”实验操作时,发现几支试管中气泡有快有慢,于是他与小芳同学一起合作进行如下探究.
小民同学在练习“金属的化学性质”实验操作时,发现几支试管中气泡有快有慢,于是他与小芳同学一起合作进行如下探究.| 实验编号 | 盐酸的浓度 (均取20mL) | 金属 (均取2g) | 金属的形状 | 收集50mL氢气所需要时间/s |
| ① | 10% | 镁 | 粉状 | 60 |
| ② | 10% | 铁 | 片状 | 120 |
| ③ | 10% | 镁 | 片状 | 102 |
| ④ | 20% | 铁 | 片状 | 110 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | CO2、CH4 | B. | H2、CO | C. | H2、CH4 | D. | CO、CH4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com