有一种含水的过氧化氢样品10g,在二氧化锰的催化作用下,完全分解得到3.2g氧气,试求该样品中过氧化氢的质量分数.
【答案】
分析:利用过氧化氢分解的化学方程式和生成氧气的质量,列出比例式,就可计算出该样品中过氧化氢的质量,然后根据质量分数公式计算即可.
解答:解:设参与反应的H
2O
2质量为x,
2H
2O
2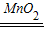
2H
2O+O
2↑
68 32
x 3.2g
∴
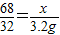
,
解之得:x=
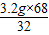
=6.8g;
则该样品中过氧化氢的质量分数为:
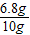
×100%=68%.
答:该样品中过氧化氢的质量分数为68%.
点评:本题主要考查学生利用化学方程式和质量分数公式进行计算的能力.解题的关键是利用化学方程式求出该样品中过氧化氢的质量.在解答过程中要注意解题的格式.

 阅读快车系列答案
阅读快车系列答案