
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:初中化学 来源: 题型:
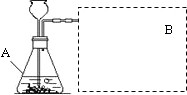 探究H2O2生成O2的快慢与催化剂种类有关.
探究H2O2生成O2的快慢与催化剂种类有关.| 实验编号 | 1 | 2 |
| 反应物 | 6%H2O2 | 6%H2O2 |
| 催化剂 | 1g红砖粉 | 1g MnO2 |
| 所需时间 | 152s | 35s |
查看答案和解析>>
科目:初中化学 来源: 题型:
| 1 H 氢 |
 |
2 He 氦 | ||||||
| 3 Li 锂 |
4 Be 铍 |
5 B 硼 |
6 C 碳 |
7 N 氮 |
8 O 氧 |
9 F 氟 |
10 Ne 氖 | |
| 12 Mg 镁 |
13 A1 铝 |
14 Si 硅 |
15 P 磷 |
16 S 硫 |
X C1 氯 |
18 Ar 氩 | ||
 所表示的粒子符号是
所表示的粒子符号是查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 编号 | 盐酸 | NaOH溶液 | △t/℃ |
| 1 | 3.65% | 2.00% | 3.5 |
| 2 | 3.65% | 4.00% | x |
| 3 | 7.30% | 8.00% | 14 |
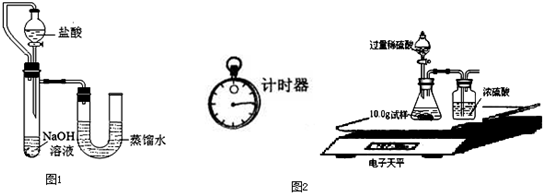
| 称 量 项 目 | 称 量 时 间 | 质量(g) |
| 试样 | 10.00 | |
| 装置+稀硫酸质量 | 241.20 | |
| 装置+稀硫酸质量+试样 | 反应开始后15秒 | 249.20 |
| 装置+稀硫酸质量+试样 | 反应开始后35秒 | 249.00 |
| 装置+稀硫酸质量+试样 | 反应开始后55秒 | 249.00 |
查看答案和解析>>
科目:初中化学 来源:2011届江苏省南京市第三初级中学九年级上学期期中考试试卷(带解析) 题型:计算题
(6分)小强在公共场所围墙上看到一则化肥广告(如图),他通过计算判断出该广告是虚假广告,并向有关部门反映。
(1)请计算硝酸铵中各元素的质量比。(请写出详细的计算过程)
(2)已知该产品中的杂质不含氮元素,请你尝试写出小强的计算过程和判断依据。(请写出详细的计算过程)
(3)技术监督局对该产品进行取样分析,发现氮元素的质量分数仅为28%。请计算该产品中硝酸铵的质量分数。(请写出详细的计算过程)
查看答案和解析>>
科目:初中化学 来源:2010-2011学年江苏省南京市九年级上学期期中考试试卷(解析版) 题型:计算题
(6分)小强在公共场所围墙上看到一则化肥广告(如图),他通过计算判断出该广告是虚假广告,并向有关部门反映。

(1)请计算硝酸铵中各元素的质量比。(请写出详细的计算过程)
(2)已知该产品中的杂质不含氮元素,请你尝试写出小强的计算过程和判断依据。(请写出详细的计算过程)
(3)技术监督局对该产品进行取样分析,发现氮元素的质量分数仅为28%。请计算该产品中硝酸铵的质量分数。(请写出详细的计算过程)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com