
什么是溶质的质量分数?它表示的含义是什么?
溶质质量分数是用来描述物质组成的一种方法,实质上就是溶质在溶液中所占的百分比。
【解析】考点定位分析:本题的考点是溶质的质量分数的含义。溶质质量分数是用来描述物质组成的一种方法,实质上就是溶质在溶液中所占的百分比。其含义是指100份质量的某溶液中含多少份质量的该溶质。
解答过程分析:溶质的质量分数可用下式表示:
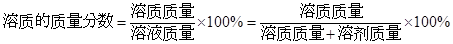 ,对溶液中溶质的质量分数表示的含义有以下几点:
,对溶液中溶质的质量分数表示的含义有以下几点:
1、溶质的质量分数是溶液组成的一种表示方法,所指溶液可以是饱和溶液,也可以是不饱和溶液。
2、溶质的质量分数是质量之比,一般与温度无关。溶质的质量分数是比值,没有单位。
3、由于溶液的组成是指溶质在溶解度范围之内,溶液各成分在量方面的关系。因此,对溶液组成的变化来说,某物质的质量分数只能在一定范围内才有意义,即溶液中最大的溶质质量分数是由溶解度决定的,而溶解度受制于温度,所以要讨论溶液中的最大溶质质量分数也必须在一定温度下才有意义。
试题总结评价:本题很容易,就是要求学生要熟记和理解溶质的质量分数及其有关计算方法。


科目:初中化学 来源: 题型:阅读理解
| 实验内容 | 预计现象 | 预计结论 |
| 取少量废液缸中上 层清液于试管中, 加入过量氯化钙 溶液,静置. |
①没有白色沉淀,溶液呈红色. | |
| ②有白色沉淀,溶液由红色变 为无色 |
||
| ③ |
你的猜想正确. |
查看答案和解析>>
科目:初中化学 来源: 题型:
| A、20℃时所得溶液的质量为25g | B、40℃时所得溶液为饱和溶液 | C、不管什么温度下,所得溶液中溶质的质量分数均为20% | D、该物质的溶解度随温度的升高而增大 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| 实验序号 | 过氧化氢溶液浓度/% | 过氧化氢溶液质量/g | 温度/℃ | 二氧化锰用量/g | 氧气体积/ml | 反应所需时间/s |
| ① | 5 | 12 | 20 | 0.2 | 125 | 11 |
| ② | 30 | 12 | 20 | 0.2 | 125 | 2 |
| ③ | 30 | 12 | 40 | / | 125 | 148 |
| ④ | 30 | 12 | 90 | / | 125 | 82 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 氢氧化钠 | 氯化钠 | 氢氧化钙 | 碳酸钠 | |
| 溶解度/g(20℃) | 51 | 36 | 0.16 | 21.5 |
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量样品溶液于试管中,滴加 稀盐酸 稀盐酸 . |
有气泡产生 有气泡产生 |
该溶液是碳酸钠溶液. 有关反应的化学方程式为: Na2CO3+2HCl═2NaCl+H2O+CO2↑ Na2CO3+2HCl═2NaCl+H2O+CO2↑ . |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com