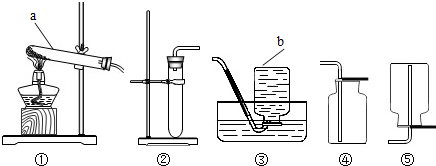
“神州七号”飞船的成功发射是我国航天事业的又一里程碑.“神州七号”太空舱利改变了“神舟”六号利用过氧化钠(Na
2O
2)在常温下能与人呼出的二氧化碳反应生成氧气的原理,而是采用NiFe
2O
4将航天员呼出的CO
2转化为O
2,而NiFe
2O
4的质量和化学性质都不变化,从而减少携带物品的质量.
(1)在该过程中NiFe
2O
4是
.若NiFe
2O
4中Fe的化合价为+3价,则Ni的化合价为
.
(2)过氧化钠和二氧化碳反应的化学方程式为:2Na
2O
2+2CO
2═2Na
2CO
3+O
2↑.为了验证该反应中氧气的产生,某兴趣小组的同学设计了如图所示的实验.
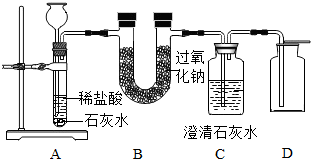
A装置中所发生反应的化学方程式为
;实验前,把A、B、C、D中的玻璃管相连时,都是通过胶皮管连接,为了能顺利地连接,你的方法是
;检查A装置的气密性的方法是:将A装置中导气管上的胶皮管用弹簧夹夹住,往长颈漏斗中注入水至液面高出漏斗颈的下端管口,若能观察到
现象,即可证明装置不漏气.
(3)表明二氧化碳没有被过氧化钠完全吸收的现象是
.
(4)用向上排空气法收集氧气,并用带火星的木条放在集气瓶口检验氧气是否收集满,这是利用了氧气的哪些性质?
(5)常温下水也能与Na
2O
2反应,生成氧气和氢氧化钠,写出该反应的化学方程式.若要检验干燥的二氧化碳能否与过氧化钠反应生成氧气,以上实验装置应如何改进?
(6)某潜水艇上有4人,如果每人每小时消耗的氧气在某温度和压强条件下体积为50L,则该潜水艇中每天需要过氧化钠多少千克?(已知:在上述温度和压强条件下氧气的密度为1.5g/L)



 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案