
【题目】(1)金属铁及其化合物在生产生活中有极其广泛的应用。
①高铁酸钠(化学式Na2FeO4)是一种含铁元素的新型绿色消毒剂,主要用于饮用水处理。此化合物中铁元素的化合价为_____。
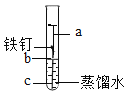
②小雪同学在探究铁生锈条件的实验时,按图装置进行实验,一周后发现铁钉锈蚀最严重的位置是_____处(从“a”“b”“c”中选择之一),取出铁钉后,她用盐酸除去表面的铁锈(主要成分为Fe2O3),发生反应的化学方程式为_____。
(2)我国海岸线长达3.2万千米。海洋专属经济区幅员辽阔,海洋资源丰富,开发的前景十分远大。海水中除了蕴含大量的钠元素和镁元素外,还含有大量的钾元素。KCl和KNO3的溶解度曲线如图所示,试回答下列问题:
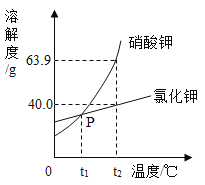
①t2℃时,硝酸钾的溶解度_____氯化钾的溶解度(填“大于”“等于”“小于”之一)。
②将t2℃时氯化钾的饱和溶液70g稀释成溶质质量分数为20%的氯化钾溶液。需加水_____g。
③将t1℃时硝酸钾饱和溶液和氯化钾饱和溶液分别升温至t2℃,此时硝酸钾溶液的溶质质量分数_____氯化钾溶液的溶质质量分数(选填"大于”“等于”“小于”“无法确定之一)。
【答案】+6 b ![]() 大于 30 等于
大于 30 等于
【解析】
根据化合价的计算、铁生锈的条件、酸的性质及化学方程式的书写、溶解度曲线的应用和溶质的质量分数分析作答。
(1)①设化学式Na2FeO4中铁元素的化合价为x,已知Na的化合价为+1价,O的化合价为-2价,根据化合物中正负化合价的代数和为零列出计算式:![]() ,解得x= +6;
,解得x= +6;
②小雪同学在探究铁生锈条件的实验时,一周后发现铁钉锈蚀最严重的位置是b处,因为b是同时接触铁、水和氧气的量多,最有利反应的进行;用盐酸除去表面的铁锈(主要成分为Fe2O3),发生反应的化学方程式是![]() ;
;
(2)①由图像知道t2℃时,硝酸钾的溶解度大于氯化钾的溶解度;
②t2℃时氯化钾的溶解度是40g,70g饱和溶液中的溶质质量是:![]() ,设加入水的质量为y,根据稀释前后溶质的质量不变有:
,设加入水的质量为y,根据稀释前后溶质的质量不变有:![]() ,解得y=30g;
,解得y=30g;
③t1℃时硝酸钾和氯化钾的溶解度相等,则它们的饱和溶液中溶质的质量分数相等,分别升温至t2℃,两溶液都变成了不饱和溶液,原有的溶质和溶剂的质量不变,所以此时硝酸钾溶液的溶质质量分数等于氯化钾溶液的溶质质量分数。


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案科目:初中化学 来源: 题型:
【题目】请根据下图回答问题:
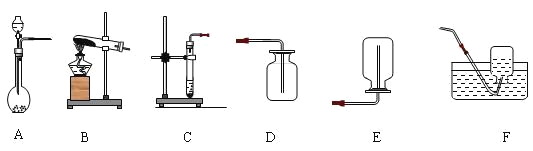
(1)实验室里用过氧化氢溶液与二氧化锰固体混合制取氧气,为了控制反应进行的速率,最好选用发生装置____,写出用过氧化氢溶液制取氧气反应的化学方程式___。
(2)实验室里常用___和___在常温下反应制取二氧化碳,可选用的发生装置是____,收集装置是____,请写出实验室制取二氧化碳的化学方程式___________。
(3)实验室里可用氢氧化钙与氯化铵的固体加热制取氨气,则发生装置可选___,一般只能用E装置收集氨气,据此推测氨气的物理性质有____、____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】结合下图所示实验流程,回答问题。
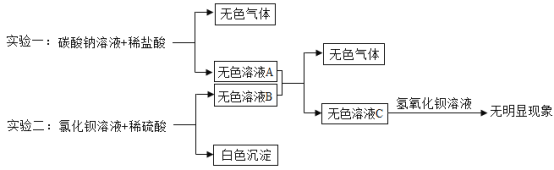
(1)写出无色溶液A中阴离子的符号_____。
(2)写出实验二反应的化学方程式_____。
(3)将无色气体通入到Ba(OH)2溶液中,会观察到的现象是_____。
(4)进一步确定无色溶液C中溶质的成分,取样无色溶液C,滴加过量的试剂是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是物质A、B的溶解度曲线,下列说法正确的是

A. 两种物质的溶解度都随温度的升高而增大
B. t2℃时,将溶液A、B降温至t1℃都有晶体析出
C. t1℃时,溶液A、B的溶质质量分数一定相等
D. t2℃时,所配溶液A的溶质质量分数不超过28.6%
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是家庭中一些常见食品及生活用品的pH。下列说法正确的是( )

A.从以上物质的pH值看,肥皂水的碱性比玉米粥的碱性弱
B.在白醋中滴加几滴无色酌酞试液后,溶液变成红色
C.被蚊叮咬(分泌物中含蚁酸)可徐抹少量牙膏减轻疼痛
D.从食物本身的酸碱性来看,胃酸过多的人宜多吃葡萄来减缓不适
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】“宏观—微观—符号”三重表征是化学独特的表示物质及其变化的方法。某化学反应的微观示意图如图所示,下列说法不正确的是![]()
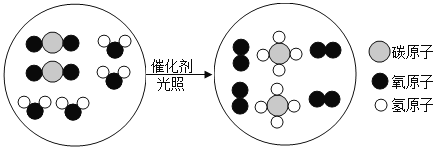
A.从微观构成看:四种物质均由分子构成
B.从物质分类看:该反应涉及到2种氧化物
C.从反应价值看:该反应能获取清洁能源
D.从表示方法看:该反应的化学方程式为2CO2+4H2O 2CH4+4O2
2CH4+4O2
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】利用如图1仪器进行气体的制取实验,并分析回答问题。![]() 查阅信息:二氧化碳难溶于饱和的碳酸氢钠溶液且不与碳酸氢钠发生反应
查阅信息:二氧化碳难溶于饱和的碳酸氢钠溶液且不与碳酸氢钠发生反应![]()

(1)仪器B、G的名称分别是_____和_____。
(2)用一定质量的氯酸钾和二氧化锰的混合物制取并收集一瓶较纯净的O2,应选用图中的仪器有_____(填字母序号),此反应的化学方程式为_____,该反应过程固体混合物中二氧化锰的质量分数_____(填“增大”或“减小”或“不变”)。
(3)若用如图2装置制备二氧化碳或氢气,需改进之处为:_____,改进后该装置的优点是_____。

(4)收集二氧化碳可采用的方法有_____。
A向上排空气法
B向下排空气法
C排饱和碳酸氢钠溶液
(5)阅读“资料”卡片,分析下列说法正确的是_____![]() 填序号
填序号![]() 。
。
资料
1.氨气是有刺激性气味的无色气体,密度比空气小,极易溶于水,其水溶液呈碱性;
2.加热熟石灰和氯化铵的固体混合物生成氨气。
A制取氨气的发生装置与实验室用双氧水制氧气的发生装置相同
B若用如图3装置收集氨气,进气口应为n端
C检验氨气集满的方法是将干燥的红色石蕊试纸放在m管口,若变蓝则已满
D实验室可用浓硫酸干燥氨气
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】已知 Na2CO3与 HCl 反应分两步进行:
第一步 Na2CO3与 HCl 反应生成 NaHCO3:![]() ;
;
第二步 NaHCO3 与 HCl 反应生成 CO2:![]() 。
。
现有这样一个实验:在两支试管中分别加入 3mL 稀盐酸,将两个各装有 0.3g NaHCO3 或 Na2CO3 粉末的小气球分别套在两支试管口,将气球内的NaHCO3或 Na2CO3 同时倒入试管中(反应中盐酸足量)。观察到现象如下:
(1)盛________的试管中产生气体的速率要快得多。
(2)盛_________的试管中气球变得更大,大小气球中生成气体的质量之比为(填最简单整数比)_____。
(3)甲同学用手触摸试管,发现盛 NaHCO3 粉末的试管变冷,而盛 Na2CO3的试管温度有升高。为研究是吸热还是放热反应,继续进行了下列实验(每次实验各做 3 次平行实验,取平均值):
序号 | 试剂 1 | 试剂 2 | 混合前温度 | 混合后温度 |
① | 35mL 水 | 2.5g NaHCO3固体 | 20℃ | 18.5℃ |
② | 35mL 水 | 3.2 Na2CO3固体 | 20℃ | 24.3℃ |
③ | 35mL 稀盐酸 | 含2.5g NaHCO3的饱和溶液 32.5mL | 20℃ | 19℃ |
④ | 35mL 稀盐酸 | 含 3.2g Na2CO3的饱和溶液 23.1mL+10ml 水 | 20℃ | 24.2℃ |
⑤ | 35mL 稀盐酸 | 2.5gNaHCO3固体 | 20℃ | 16.2℃ |
⑥ | 35mL 稀盐酸 | 3.2g Na2CO3固体 | 20℃ | 25.1℃ |
通过上述实验可得出五条结论:
①NaHCO3 的溶解是__(吸热或放热)过程;
②Na2CO3 的溶解是____(吸热或放热)过程;
③NaHCO3 的饱和溶液和盐酸的反应是___(吸热或放热)反应;
④Na2CO3 的饱和溶液和盐酸的反应是____(吸热或放热)反应;
⑤NaHCO3 固体与稀盐酸反应的反应热是由_____(填①~⑤序号)的热效应之和。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某兴趣小组设计了如图装置来探究铁生锈的条件,他们首先进行检查装置气密性,方法是_____________________________________。然后放入药品进行实验探究,一段时间后他们观察到的现象是_________________________________。但有同学认为该实验设计不能达到目的,理由可能是___________________________________________。
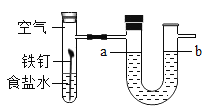
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com