
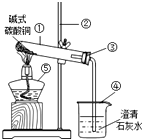
 某化学兴趣小组为了探究氧化铜能否代替二氧化锰作为双氧水的催化剂,进行以下探究:
某化学兴趣小组为了探究氧化铜能否代替二氧化锰作为双氧水的催化剂,进行以下探究:| 实验步骤 | 实验现象 | 实验结论 |
| ①在试管中加入2ml5%的过氧化氢溶液,将带火星的小木条伸入试管中 | 木条不复燃 | 在常温下,双氧水分解速率很慢 |
| ②在试管中加入2ml5%的过氧化氢溶液,加入0.1g的氧化铜,将带火星的小木条伸入试管 | 木条复燃 | 氧化铜可以加快双氧水的分解速率 |
分析 (1)碱式碳酸铜是一种常见绿色粉末状物质,受热可分解出氧化铜、二氧化碳和水;
(2)根据二氧化碳与氢氧化钙反应生成碳酸钙和水分析;
【实验一】根据过氧化氢的分解条件及现象分析.
【实验二】根据催化剂的探究实验分析;
【实验三】根据催化剂的特点及验证方法分析;
解答 解:(1)碱式碳酸铜是一种常见绿色粉末状物质,受热可分解出氧化铜、二氧化碳和水. 现象为绿色固体逐渐变成黑色固体,试管口产生水珠,同时生成能使澄清石灰水变浑浊的气体.
(2)烧杯中是二氧化碳与氢氧化钙的反应,二氧化碳与氢氧化钙反应生成碳酸钙和水,其文字表达式为:二氧化碳+氢氧化钙→碳酸钙+水;
【实验一】①在试管中加入2ml5%的过氧化氢溶液,将带火星的小木条伸入试管中,木条不复燃,这说明过氧化氢没分解,或生成氧气的量较少;②在试管中加入2ml5%的过氧化氢溶液,加入0.1g的氧化铜,将带火星的小木条伸入试管,木条复燃,说明氧化铜可加快过氧化氢的分解速率;
【实验二】要证明氧化铜是反应的催化剂,还要证明氧化铜的质量在反应前后是否不变,故要收集反应后的氧化铜,称量后和反应前进行比较;
【实验三】要证明氧化铜是反应的催化剂,还要证明氧化铜的化学性质在反应前后是否不变,故要重新设计实验验证反应后的氧化铜是否具有相同的性质;
故答案为:(1)绿,黑;
(2)二氧化碳+氢氧化钙→碳酸钙+水;
(3)在常温下,双氧水分解速率很慢;
氧化铜可以加快双氧水的分解速率;
(4)探究氧化铜在反应前后质量是否改变;
(5)复燃;
氧化铜在反应前后化学性质不变;
点评 了解催化剂的特点,过氧化氢的分解原理,及氧化铜可作过氧化氢反应的催化剂即可顺利解答.


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案科目:初中化学 来源: 题型:选择题
| 选项 | 需区分的物质 | 所用方法 |
| A | 白酒和白醋 | 闻气味 |
| B | 铜丝和铁丝 | 观察颜色 |
| C | 食盐与白糖 | 尝味道 |
| D | 氧气和空气 | 燃着的木条 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 铜片放入硝酸银溶液中:紫红色固体表面有银白色固体析出,溶液由无色逐渐变为蓝色 | |
| B. | 打开浓盐酸试剂瓶,在瓶口有白烟产生 | |
| C. | 铁丝在空气中加热:银白色固体剧烈燃烧,火星四射,放出大量的热,生成黑色固体 | |
| D. | 铜片放入稀盐酸中:紫红色固体表面产生气泡,固体减少,溶液由无色逐渐变为蓝色,放热 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 尝药品的味道 | |
| B. | 实验剩余的药品放回原试剂瓶中 | |
| C. | 加热试管里的液体时,试管口不能朝着自己或他人 | |
| D. | 用燃着的酒精灯点燃另一酒精灯 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 味精 | B. | 食盐 | C. | 白醋 | D. | 酱油 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
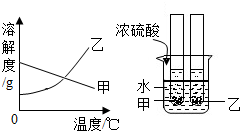 甲、乙两种固体物质的溶解度曲线如图所示.现将两支分别装有甲、乙两种物质饱和溶液(底部均有未溶解的固体)的试管浸入盛有水的烧杯里,然后向烧杯中加入一定量的浓硫酸,则对相关变体判断正确的是( )
甲、乙两种固体物质的溶解度曲线如图所示.现将两支分别装有甲、乙两种物质饱和溶液(底部均有未溶解的固体)的试管浸入盛有水的烧杯里,然后向烧杯中加入一定量的浓硫酸,则对相关变体判断正确的是( )| A. | 甲溶液中溶质的质量分数增大 | B. | 乙溶液中未溶解的固体质量减小 | ||
| C. | 甲、乙物质的溶解度都增大 | D. | 乙溶液中溶质的质量分数不变 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 明朝名臣、民族英雄于谦的诗作《石灰吟》:
明朝名臣、民族英雄于谦的诗作《石灰吟》:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验编号 | 实验药品 | 分解温度(℃) |
| ① | KClO3 | 580 |
| ② | KClO3、MnO2(质量比1:1) | 350 |
| ③ | KClO3、CuO(质量比1:1) | 370 |
| ④ | KClO3、Fe2O3(质量比1:1) | 390 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com