
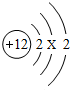 将宏观、微观及化学符号联系在一起是化学学科的特点.
将宏观、微观及化学符号联系在一起是化学学科的特点.分析 (1)首先根据反应原理找出反应物、生成物、反应条件,根据化学方程式的书写方法、步骤(写、配、注、等)进行书写即可.
(2)①当质子数=核外电子数,为原子.
②根据化学方程式的含义,进行分析判断.
③根据化合价的原则进行分析判断.
④根据镁能在二氧化碳中燃烧,进行分析判断.
解答 解:(1)①铁在氧气中燃烧剧烈燃烧,火星四射,生成四氧化三铁,反应的化学方程式为3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4.
②喝啤酒打嗝是因为碳酸分解生成水和二氧化碳,反应的化学方程式为H2CO3═H2O+CO2↑.
③氧炔焰燃烧是乙炔与氧气反应生成二氧化碳和水,反应的化学方程式为2C2H2+5O2$\frac{\underline{\;点燃\;}}{\;}$4CO2+2H2O.
④用澄清石灰水检验二氧化碳气体,生成碳酸钙和水,反应的化学方程式为:CO2+Ca(OH)2═CaCO3↓+H2O.
①符合“多变一”的特征,属于化合反应;又是物质与氧气发生的反应,属于氧化反应.
(2)①当质子数=核外电子数,为原子,12=2+X+2,X=8,故选项说法正确.
②由反应的化学方程式可知,镁与二氧化碳是反应物,故选项说法正确.
③该反应中反应前后氧元素的化合价均为-2价,氧元素的化合价没有发生变化,故选项说法错误.
④镁能在二氧化碳中燃烧,不是所有可燃物的燃烧都能用二氧化碳灭火,故选项说法正确.
故答案为:(1)①3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4;②H2CO3═H2O+CO2↑;③2C2H2+5O2$\frac{\underline{\;点燃\;}}{\;}$4CO2+2H2O;④CO2+Ca(OH)2═CaCO3↓+H2O;①;
(2)③.
点评 本题难度不大,掌握化学方程式的书写方法、原子结构示意图的含义、化合价的原则等是正确解答本题的关键.


科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验步骤 | 实验现象 | 实验结论及化学方程式表示 |
| 取少量白色固体于试管中,向试管中滴加适量稀盐酸 | 有气泡 | 反应后生成的白色固体是Na2CO3 钠在二氧化碳中燃烧的化学方程式为: 4Na+3CO2$\frac{\underline{\;点燃\;}}{\;}$2Na2CO3+C |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验方案 | 测溶液pH | 滴加Na2CO3溶液 | 滴加BaCl2溶液 |
| 实验操作 |  | 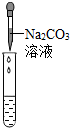 | 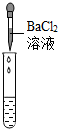 |
| 实验现象 | 试纸变色,对比比色卡,pH<7 | 有气泡产生 | 产生白色沉淀 |
| 实验结论 | 溶液中有H2SO4 | 溶液中有H2SO4 | 溶液中有H2SO4 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A.物质的俗名 | B.物质的分类 |
| 氢氧化钠的俗名-苛性钠 氢氧化钙的俗名--消石灰 | CH3COOH--酸 NH3•H2O--碱 |
| C.物质的物理性质 | D.物质的鉴别 |
| 干冰能升华 氧化钙加水放热 | 化纤与纯羊毛面料-燃烧 食盐与碱面-加食醋 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
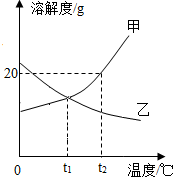 甲、乙两种物质的溶解度曲线如图,下列说法中正确的是( )
甲、乙两种物质的溶解度曲线如图,下列说法中正确的是( )| A. | 升温能使甲物质的不饱和溶液变为饱和溶液 | |
| B. | t2℃时,乙物质的溶解度比甲物质的溶解度大 | |
| C. | t1℃时,甲、乙两种饱和溶液的溶质质量分数相同 | |
| D. | t2℃时将甲、乙两饱和溶液降温到t1℃时,乙析出晶体较多 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com