
【题目】某校化学兴趣小组欲探究 CO2 与 NaOH 溶液反应后的溶质组成。
(查阅资料)20℃时,几种物质在水中的溶解度(S):
物质 | Na2CO3 | NaHCO3 | Ca(OH)2 | Ba(OH)2 | NaOH |
S/g | 21.5 | 9.6 | 0.165 | 3.89 | 109 |
(实验探究Ⅰ)
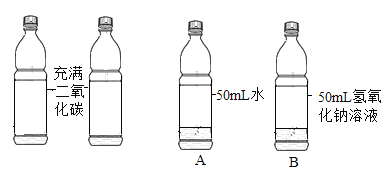
实验一:取两只充满 CO2 的矿泉水瓶,分别加入50mL 的水和等体积的 NaOH 溶液,立即拧紧瓶盖, 实验如图,充分振荡。瓶子变瘪程度 A______B(填 “>”“=”“<”)。
实验二:验证 B 瓶中反应生成了 Na2CO3:取少量 B 瓶中的溶液,滴加过量 BaCl2 的溶液,有白色沉淀生成,静置。
(1)该反应的化学方程式为______。
(2)实验中不宜将 BaCl2 溶液换成 CaCl2 溶液,原因是______。
实验三:取少量实验二中的上层清液,滴入几滴酚酞。
(3)溶液变红色。说明清液中还有 NaOH。
(4)实验二中必须加入过量的 BaCl2 溶液,理由是______。
(实验探究Ⅱ)
(查阅资料)
(1)本实验条件下,NaOH 溶液、Na2CO3 溶液和NaHCO3 溶液的 pH 分别约为 14.0、12.0和 8.5。
(2)将 CO2 通入少量的澄清石灰水中,溶液变浑浊,继续通 CO2 气体,浑浊逐渐消失, 其消失过程中发生的反应为:CaCO3 + H2O + CO2 =Ca(HCO3)2
(提出猜想)过量 CO2 与 NaOH 溶液反应后的溶质中还可能含有______(填化学式)。
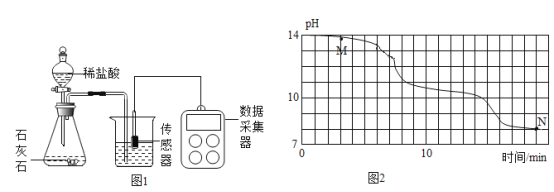
(进行实验)小明在老师的帮助下利用数字传感器完成了以下实验。室温(约 20℃)下, 将 8gNaOH 溶于 190g 水中,然后向其中持续通入二氧化碳气体,同时用数字传感器测定溶液的 pH 变化,所得数据如图 2 所示。
(得出结论)
(1)实验中,用“分液漏斗”而不用“长颈漏斗”的原因是______;
(2)根据资料和图像判断:M点溶质应为______(填化学式);
(反思交流)
(1)经多次重复实验,所得实验结果基本一致。实验过程中发现 18min 后溶液的 pH 基本不再变化,则此时烧杯内______(填“有”或“无”)晶体析出,原因是______。
(2)待 pH 不再变化后,取适量溶液,向其中滴加几滴稀盐酸,立即产生气泡,该反应的化学方程式为_______。
【答案】< ![]() 氯化钙溶液容易和没有反应完的 NaOH 得到微溶的 Ca(OH)2,出现白色沉淀,无法证明碳酸钠的生成 除去所有的 Na2CO3 NaHCO3 分液漏斗可以控制反应速率,得到平稳的 CO2 气流 NaOH、Na2CO3 无 产生的 NaHCO3 并未超过溶解度,不会有晶体析出
氯化钙溶液容易和没有反应完的 NaOH 得到微溶的 Ca(OH)2,出现白色沉淀,无法证明碳酸钠的生成 除去所有的 Na2CO3 NaHCO3 分液漏斗可以控制反应速率,得到平稳的 CO2 气流 NaOH、Na2CO3 无 产生的 NaHCO3 并未超过溶解度,不会有晶体析出 ![]()
【解析】
实验探究Ⅰ:
实验一:二氧化碳能溶于水且与水反应生成碳酸,二氧化碳能与氢氧化钠反应生成碳酸钠和水,瓶子内二氧化碳减少,压强减小,两个瓶子会变瘪,氢氧化钠吸收的二氧化碳较多,故瓶子变瘪程度 A<B;
实验二:(1)碳酸钠与氯化钡反应生成碳酸钡和氯化钠,该反应的化学方程式为:![]() ;
;
(2)如果用氯化钙,钙离子能与氢氧根结合成氢氧化钙,氢氧化钙微溶于水,生成比较多氢氧化钙时,也会出现白色沉淀,会干扰试验结果的判断,无法验证碳酸钠的生成,故填:氯化钙溶液容易和没有反应完的 NaOH 得到微溶的 Ca(OH)2,出现白色沉淀,无法证明碳酸钠的生成;
实验三:碳酸钠溶液呈碱性,也能使无色酚酞变红,所以验证 NaOH 时必须要保证碳酸钠被完全除去,因此必须加入过量的氯化钡,故填:除去所有的Na2CO3;
实验探究Ⅱ:
提出猜想:过量二氧化碳能与碳酸钙、水反应生成碳酸氢钙,故过量二氧化碳可能与碳酸钠、水反应生成碳酸氢钠,故填: NaHCO3;
得出结论:(1)题目要求持续通入二氧化碳,绘制时间关系图,所以需要控制反应气流速度,分液漏斗可以通过控制药品的滴加速率,从而控制反应速率,从而得到平稳的二氧化碳气流,故填:分液漏斗可以控制反应速率,得到平稳的 CO2 气流;
(2)由图可知,M点pH约为13,由资料可知,NaOH 溶液、Na2CO3 溶液的 pH 分别约为 14.0、12.0,故此时,氢氧化钠与二氧化碳反应生成了碳酸钠,但是氢氧化钠未完全反应,故M点溶质应为:NaOH、Na2CO3;
反思交流:18min 时,pH已经基本不再变化,说明此时反应已经全部结束,所以 NaOH 均已经反应生成了碳酸氢钠,根据质量守恒定律,化学反应前后,原子的种类和质量不变,故氢氧化钠中的钠元素全部转化到了碳酸氢钠中,氢氧化钠中钠元素的质量为:![]() ,故生成碳酸氢钠的质量为
,故生成碳酸氢钠的质量为![]()
20℃时,NaHCO3 的溶解度为9.6g,即100g水中最多能溶解9.6g碳酸氢钠,故190g 水中最多能溶解18.24g碳酸氢钠,16.8g没有超过溶解度,不会析出,故填:无;产生的 NaHCO3 并未超过溶解度,不会有晶体析出
(2)pH 不变后,溶质为 NaHCO3,碳酸氢钠与稀盐酸反应生成氯化钠、二氧化碳和水,该反应的化学方程式为:![]() 。
。


科目:初中化学 来源: 题型:
【题目】如图是a、b两种固体物质(不含结晶水)的溶解度曲线。下列说法正确的是( )
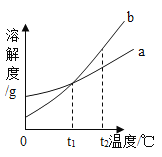
A.b的溶解度大于a的溶解度
B.t1℃时,将a、b两种物质的溶液分别恒温蒸发等质量的水,析出晶体的质量一定相等
C.将t2℃时b的不饱和溶液降温至t1℃,不一定能得到b的饱和溶液
D.t2℃时,a溶液的溶质质量分数一定小于b溶液的溶质质量分数
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】利用图1装置进行实验,先后将溶液快速全部推入,测得一段时间内压强变化如图2所示。下列说法不正确的是
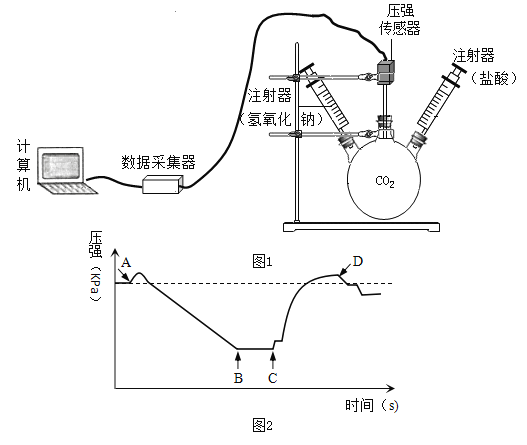
A.先推入的是NaOH溶液
B.BC段,CO2与NaOH反应基本停止
C.D点压强比初始瓶内压强大,此时瓶内二氧化碳气体的量比初始多
D.最终压强比初始压强小,可能是因为有部分二氧化碳溶于水
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】分类、类比是初中化学常用的学习方法。初中化学有许多实验,若按照实验主要目的可将实验分为:物质发生化学反应条件的探究,物质性质的探究,物质含量的探究等。按实验目的将下列实验中的B与______(填字母)归为一类,分类的依据是______。
|
|
|
|
A | B | C | D |
(2)![]() 年,俄国学者贝开托夫
年,俄国学者贝开托夫![]() 在实验的基础上,根据金属和金属离子间互相置换的大小,以及金属跟酸、水等反应的剧烈程度,首先确定了金属活动性顺序,在这个顺序里包括了氢。在金属活动性顺序中活动性越强,其金属的还原性也越强。确定金属的活动性也可以根据元素在元素周期表中的位置判断,如图是元素周期表的一部分。请回答下列问题。
在实验的基础上,根据金属和金属离子间互相置换的大小,以及金属跟酸、水等反应的剧烈程度,首先确定了金属活动性顺序,在这个顺序里包括了氢。在金属活动性顺序中活动性越强,其金属的还原性也越强。确定金属的活动性也可以根据元素在元素周期表中的位置判断,如图是元素周期表的一部分。请回答下列问题。
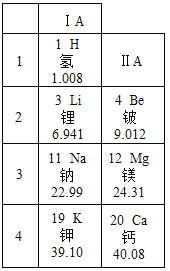
金属活动性顺序为:![]()
请推断金属铍的金属活动性比金属镁的活动性______(填“强”或“弱”);金属锂的还原性比金属镁的活动性______(填“强”或“弱”)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图所示,在乙瓶中放入用石蕊溶液染成紫色的干燥的纸花,在 A 处缓缓地持续通入混合气体 X,下表中的物质及实验操作后的现象对应关系不正确的是
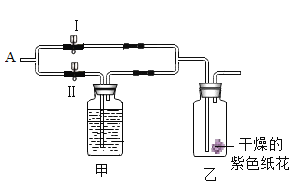
选项 | 气体 X | 甲中盛放的溶液(足量) | 关闭Ⅰ阀打开Ⅱ阀 |
A | 潮湿的混有一氧化碳的二氧化碳 | 浓硫酸 | 纸花不变色 |
B | 干燥的混有一氧化碳的二氧化碳 | 氢氧化钠溶液 | 纸花变为红色 |
C | 潮湿且混有氯化氢的二氧化碳 | 氢氧化钠溶液 | 纸花不变色 |
D | 干燥且混有氯化氢的二氧化碳 | 饱和碳酸氢钠溶液 | 纸花变为红色 |
A.AB.BC.CD.D
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】A、B、C、D、E是初中化学中常见的物质,其中E是六大基本营养素之一。它们之间转化关系如图所示:
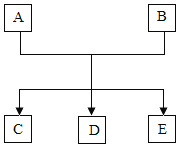
(1)若A是酸,C是食盐的主要成分,反应的化学方程式为__________。
(2)若在加热条件下,单质A能与B的浓溶液发生反应,且C溶液为蓝色,D会形成酸雨,D中组成元素的质量比为1∶1,则D的化学式为________。
(3)若A是碱,D是具有刺激性气味的气体,反应的化学方程式为_______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某学习小组同学欲利用绿色粉末碱式碳酸铜[Cu2(OH)2CO3]制备金属铜,并进行相关的实验。
[实验一]制备氧化铜并检验产物,装置如下图所示(省略夹持仪器)。
步骤一:打开弹簧夹,通入氮气。
步骤二:关闭弹簧夹,将A、B、C装置连接,并开始加热至A中固体质量不变,停止加热。
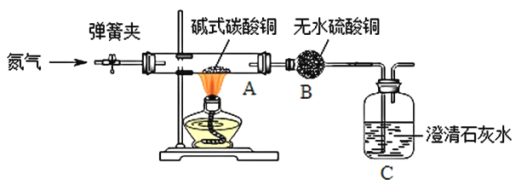
通入氮气的作用是________________;实验过程中,观察到A中有黑色固体生成,B中无水硫酸铜变蓝色、C中澄清石灰水变浑浊。碱式碳酸铜受热分解除了生成氧化铜,还生成了________________。装置C中反应的化学方程式为________________。
[实验二]用[实验一]中产生的氧化铜制备金属铜。
方法1:用一定量碳粉与[实验一] 中产生的氧化铜加热制取铜并检验产物。

实验过程中,观察到G中溶液变浑浊。E 中试管内固体反应的化学方程式是________________;装置F的作用是_____________________。
实验反思:为何[实验一]中步骤二需要加热至A中固体质量不变,才停止加热。分析可能的原因是____________________。
方法2:取适量[实验一]中产生的氧化铜,依据下列实验流程制取金属铜。

步骤I中反应的化学方程式是________________,观察到的现象是________________;步骤II中滤渣的成分是________________, 在滤渣中加入过量稀硫酸反应化学方程式是________________。
实验反思:在[实验二]中,你认为方法2优于方法1的理由是________________(写一条)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】二氧化碳与氢氧化钠溶液反应没有明显现象,某兴趣小组设计如下图所示的实验装置,欲证明二氧化碳与氢氧化钠发生反应。
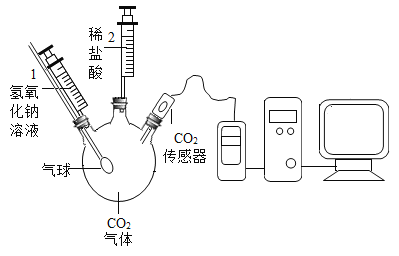
实验序号 | 实验操作 | 实验现象 |
① | 启动CO2传感器 | |
② | 将注射器1中的溶液推入充有CO2的瓶中 | 气球胀大 |
③ | 将注射器2中的溶液推入瓶中 | ________ |
(1)实验是从定量的角度验证二氧化碳与氢氧化钠的反应,绘制曲线图象如图所示:
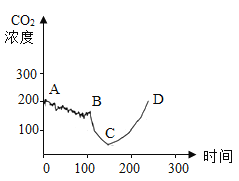
BC段发生反应的化学方程式为_________(假设氢氧化钠过量) ,CD段CO2浓度增大的原因是___________。
(2)实验结束后,向剩余的溶液中滴加酚酞溶液,发现溶液变成红色。同学们对这一现象产生了兴趣。
[提出问题]剩余溶液中,能使溶液呈碱性的物质是什么?
[猜想假设]小亮认为:只有碳酸钠
小红认为:只有氢氧化钠
小华认为:二者可能都有
[查阅资料]①同等条件下,中和反应优于酸和碳酸盐的反应
②氯化钙(或氯化钡)溶液呈中性
[交流讨论]同学们讨论后认为小红和小华的猜想均不成立。理由是__________。
[实验设计]小亮设计了如下实验,通过实验证明自己的猜想是正确的。
实验操作 | 实验现象 | 实验结论 |
①__________ | ________ | 小亮的猜想正确 |
②充分反应后,滴加几滴无色酚酞试液 | 溶液不变色 |
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】工业上用电解饱和食盐水的方法制备烧碱(NaOH)、氯气(Cl2)和氢气,并以它们为原料生产一系列化工产品,称为氯碱工业,某化学兴趣小组同学在实验室进行如下探究:
探究一:验证电解饱和食盐水的产物
(查阅资料)(1)氯气在通常情况下呈黄绿色、是一种有强烈刺激性气味的有毒气体;(2)氯气能与碱溶液发生反应,能使湿润的淀粉碘化钾试纸变蓝。
(实验验证)按图甲所示装置进行实验探究
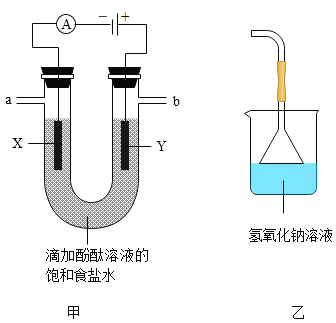
接通电源一段时间后,观察到X、Y电极周围均有气泡产生,溶液由无色变为红色。用小试管在a端收集气体,移近酒精灯火焰,松开拇指,发出轻微的爆鸣声。将湿润的淀粉碘化钾试纸放在b端,试纸变蓝。
(实验分析)
(1)a端收集到的气体是_____。
(2)电解饱和食盐水的化学方程式为_____。
(3)b端后连接乙装置,乙装置中氢氧化钠溶液的作用是_____。
(拓展延伸)上述电解饱和食盐水实验中,电解产物之间能发生化学反应。为避免产物混合发生反应,工业上常用离子交换膜法进行生产制备,将得到的溶液蒸发结晶获得烧碱。
探究二:工业上生产的烧碱中含有哪些杂质?
(猜想假设)
猜想一:NaCl
猜想二:Na2CO3
猜想三:NaCl和Na2CO3
工业上生产的烧碱中可能含有Na2CO3,作出此猜想的依据是_____。
(实验探究)
实验操作 | 实验现象 | 实验结论 |
取少量烧碱样品于试管中,加适量水溶解,加入过量的稀硝酸,再滴加少量硝酸银溶液 | _____ | 猜想三正确 |
(反思评价)
(1)小乐同学认为上述实验中可用稀盐酸代替稀硝酸,小娟不同意,小娟的理由是_____,
(2)除去烧碱溶液中少量的碳酸钠,可选用的药品是_____ (填标号)。
A CuCl2溶液
B Ba(NO3)2溶液
C Ba(OH)2溶液
D KOH溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com