将15g大理石放入100g稀盐酸中,大理石主要成分碳酸钙与盐酸恰好完全反应(杂质不反应也不溶解),剩余杂质5g.试计算:
(1)大理石中碳酸钙的质量分数;
(2)稀盐酸的质量分数;
(3)反应后所得溶液中溶质的质量分数.
解:(1)根据反应后杂质的质量为5g,所以大理石中碳酸钙的质量为15g-5g=10g,则大理石中碳酸钙的质量分数为:
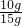
×100%≈66.7%;
(2)设反应的氯化氢质量是x 生成的氯化钙的质量是y,二氧化碳的质量是z
CaCO
3+2HCl═CaCl
2+H
2O+CO
2↑
100 73 111 44
10g x y z

=

x=7.3g y=11.1g z=4.4g
稀盐酸的质量分数为:

×100%=7.3%
(3)反应后所得溶液的质量是10g+100g-4.4g=105.6g,则反应后所得溶液中溶质的质量分数为
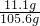
×100%≈10.5%.
答:(1)大理石中碳酸钙的质量分数为66.7%;(2)稀盐酸的质量分数为7.3%;(3)反应后所得溶液中溶质的质量分数为10.5%.
分析:因为反应时杂质不会参与反应,所以恰好反应后剩余的杂质即为大理石中杂质的质量,据此可知样品中碳酸钙的质量;利用方程式以及碳酸钙的质量可以求出反应的氯化氢质量,进而可得稀盐酸的质量分数;根据生成的氯化钙质量以及所得溶液的质量即可求出反应后所得溶液中溶质的质量分数.
点评:根据反应的化学方程式进行计算时,所使用的质量均为纯净物的质量,不纯物质的质量不能直接代入化学方程式进行计算.

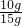 ×100%≈66.7%;
×100%≈66.7%; =
=
 ×100%=7.3%
×100%=7.3%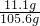 ×100%≈10.5%.
×100%≈10.5%.
