解:(1)铁生锈的过程是铁与氧气、水蒸气发生化学反应,所以与水面接触的地方易生锈,因此可以通过刷油漆的方法防止生锈.
(2)金属能做成导线是因为有导电性,抽成丝是因为有延展性,做成锅是因为导热性.
(3)铝在空气中与氧气化合,在铝的表面生成致密的氧化铝薄膜(或氧化铝膜),阻止了铝进一步与氧气的接触;
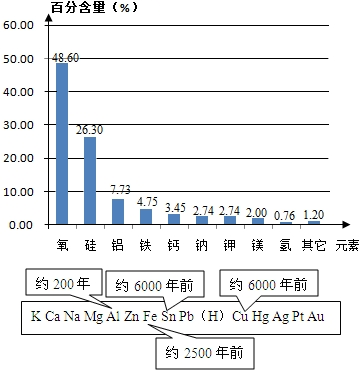
(4)由图示信息可得到,金属大规模开发、利用的先后顺序跟③金属的活动性、⑤金属冶炼的难易程度相关,活动性强的金属冶炼难度大,使用则较晚;
(5)根据化学方程式:Mg+2HCl=MgCl
2+H
2↑;2Al+6HCl═2AlCl
3+3H
2↑进行计算:
A、因为镁的活动性比铝的活动性强,镁反应速度快,故A说法正确;
B、如果盐酸均反应完,镁恰好完全反应,铝有剩余,故B说法正确;
C、如果镁、铝都反应完,则产生的氢气一定不等,说法不正确.
D、盐酸均反应完,镁、铝都反应完,生成的氢气一定相等,故D说法正确;
故选AB
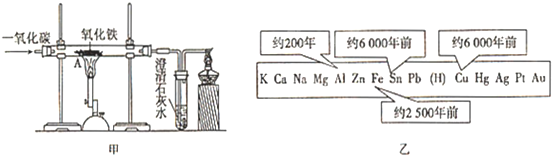
(6)一氧化碳还原氧化铁生成铁和二氧化碳,故看到的现象为固体由红变黑,澄清石灰水变浑浊,为防止生成的铁被氧化,实验结束前还要继续通一氧化碳直到冷却,故不需要断开,
(7)反应前总质量一反应后总质量=生成氢气的质量,反应完毕后总质量为166.1g,所以氢气质量=11.5+100g+55g-166.1g=0.4g
解:设生成的硫酸亚铁质量为x 铁的质量为y
Fe+H
2SO
4 =FeSO
4 +H
2↑;
56 152 2
y x 0.4g
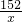
=

x=30.4g
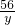
=

y=11.2g
反应后所得溶液的溶质质量分数=
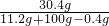
×100%=27.4%
故答案为:(1)B 刷油漆
(2)导电性或导热性(或延展性) 写出任意一个即可
(3)铝的表面形成致密的氧化膜
(4)A
(5)AB
(6)①A 固体由红变黑 B 石灰水变浑浊②不要 气体会一直通到装置冷却,不会发生倒吸
(7)0.4克 27.4%
分析:(1)根据铁生锈的条件,分析防锈方法;
(2)根据金属的用途与性质之间的关系解答.
(3)分析铝在空气中所发生的变化,解释虽然铝的活动性比铁强,但却表现出良好的抗腐蚀性的原因;
(4)利用图中数据,对比大规模开发、利用的与金属其它因素间的关系,判断与金属大规模开发、利用的先后顺序有关的因素.
(5)由已知:“用质量相等的镁粉和铝粉,分别与溶质质量分数相同、等质量的稀盐酸充分反应”,若酸完全反应,金属都剩余,则生成氢气相等,若金属完全反应,则生成氢气一定不相等.
(6)回顾一氧化碳还原氯化铁的实验,回答对该实验的操作所提出的问题.
(7)由表中的实验数据可判断第四次称量时已完全反应,利用质量守恒定律,可计算放出氢气的质量;
根据化学方程式求出生成的氯化亚铁的质量,进而求出溶液的溶质质量分数.
点评:本题为涉及较多的化学基础知识,题目难点不大但涉及面较广,耐心审题、沉着作答对于解答类似问题会有较大帮助.


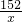 =
= x=30.4g
x=30.4g 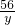 =
= y=11.2g
y=11.2g 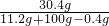 ×100%=27.4%
×100%=27.4%