
科目:初中化学 来源: 题型:选择题
| A. | ④②③⑤① | B. | ④①②③⑤ | C. | ④②①③⑤ | D. | ④②⑤③① |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验步骤 | 实验现象 | 实验结论 |
| 1.将白色粉末放于水中. | 一部分白色粉末溶于水, 形成无色溶液,一部分不溶于水. | 白色粉末中肯定不含CuSO4 |
| 2.经过滤,得到滤液和滤渣,将滤渣中加入稀硝酸 | 沉淀全部消失. | 白色粉末中肯定不含BaSO4 肯定含有BaCO3 |
| 3.在步骤2所形成的溶液中加入硝酸银 | 产生白色沉淀 现象. | 白色粉末一定含有NaClNaCl 可能含有KNO3. |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
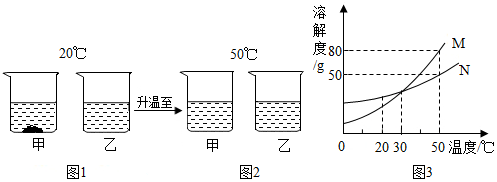
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 面粉、蔗糖灼烧后都变成炭黑,说明它们是相同的物质 | |
| B. | 二氧化碳灭火既用到物理性质,也用到化学性质 | |
| C. | 工业分离液态空气制氧气,是利用氮气和氧气密度不同而实现的,属于物理变化 | |
| D. | 空气具有自净能力,任意排放废气不会造成污染 |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
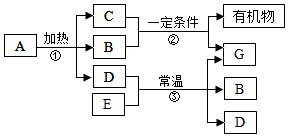 如图表示某些物质间转化关系.常温下B、E均为无色液体,D是黑色粉末,反应②是自然界中普遍存在着的反应,C是导致温室效应的主要元凶之一.
如图表示某些物质间转化关系.常温下B、E均为无色液体,D是黑色粉末,反应②是自然界中普遍存在着的反应,C是导致温室效应的主要元凶之一.查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

| 实验编号 | 实验目的 | 温度 | 催化剂 | 浓度 |
| 甲组实验Ⅰ | 探究浓度对H2O2分解速率的影响 | 25℃ | 二氧化锰 | 10mL2%H2O2 |
| 甲组实验Ⅱ | 25℃ | 二氧化锰 | 10mL5%H2O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com