
分析 (1)根据氯化钡和碳酸钠反应能够生成碳酸钡沉淀和氯化钠,和硫酸钠反应能够生成硫酸钡沉淀和氯化钠;碳酸钡溶液稀硝酸,硫酸钡不溶于稀硝酸解答;
(2)根据碳酸钠与盐酸反应能够生成氯化钠、水和二氧化碳,利用生成物及反应物是否过量进行解答;然后根据实验现象可以判断滤液中溶质的存在情况.
解答 解:
(1)甲同学取样品于试管,加水溶解后,再加入足量BaCl2溶液,氯化钡和硫酸钠反应能够生成硫酸钡沉淀和氯化钠,观察有白色沉淀现象产生,由此他得出结论:样品中含有Na2SO4.由于氯化钡和碳酸钠反应生成的碳酸钡沉淀能够和稀硝酸反应,而氯化钡和硫酸钠反应生成的硫酸钡不能和稀硝酸反应.所以乙同学认为甲同学结论不严谨,他向甲同学实验后的试管中加入足量的稀硝酸,观察到固体表面有气泡,沉淀部分溶解的现象,证明样品确实含有Na2SO4.
(2)碳酸钠与盐酸反应能够生成氯化钠、水和二氧化碳,硫酸钠与盐酸不反应,丙同学取样品溶于水后,加入一定量稀盐酸,溶液样品中溶质成分是可能是:
完全反应为:①NaCl,Na2SO4
完全反应为:②NaCl,Na2SO4和HCl;③NaCl,Na2SO4和Na2CO3 ④NaCl,Na2CO3,HCl和Na2CO3
因为碳酸钠与盐酸能够反应,不能共存,猜想④一定不成立.
【实验操作及现象】向溶液样品中加入适量稀硫酸产生气泡;
【实验结论】猜想③成立,碳酸钠有剩余,产生二氧化碳少,将产生的气体净化后通入足量的氢氧化钠溶液,根据溶液增加的质量来计算该纯碱样品中Na2CO3的质量分数偏小;
答案:
(1)白色沉淀;固体表面有气泡,沉淀部分溶解;
(2)【提出猜想】HCl;④;
【实验操作及现象】稀硫酸;
【实验结论】偏小.
点评 实验现象明显、直观,可以帮助我们更好地理解反应过程,因此要注意观察实验现象,学会分析实验现象,从而进行正确的判断.


科目:初中化学 来源: 题型:填空题
 钠摄入过量或钾摄入不足都是导致高血压的风险因素.日常生活中选择食用低钠盐能实现减钠补钾.如图为某品牌低钠盐的标签,请你根据标签回答以下问题:
钠摄入过量或钾摄入不足都是导致高血压的风险因素.日常生活中选择食用低钠盐能实现减钠补钾.如图为某品牌低钠盐的标签,请你根据标签回答以下问题:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
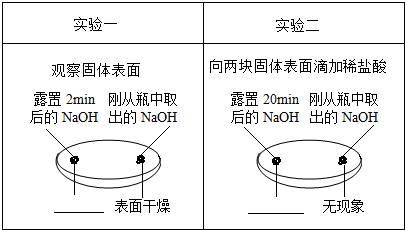
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
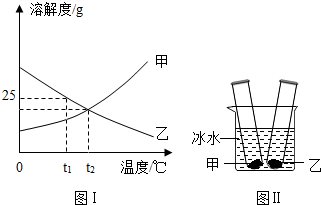 溶液在生命活动和生产、生活中起着十分重要的作用.
溶液在生命活动和生产、生活中起着十分重要的作用.查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
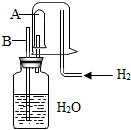 已知在相同温度下,气体分子的运动速度与分子的相对分子质量有关,分子的相对分子质量越大,则其运动速度越小.图中容器A是一种特制的有底的素烧瓷筒,它的壁可以通过氢气分子.实验开始时,A中和烧杯中都充满空气.当向烧杯持续通入氢气时,导管B处发生的现象是有水喷出.
已知在相同温度下,气体分子的运动速度与分子的相对分子质量有关,分子的相对分子质量越大,则其运动速度越小.图中容器A是一种特制的有底的素烧瓷筒,它的壁可以通过氢气分子.实验开始时,A中和烧杯中都充满空气.当向烧杯持续通入氢气时,导管B处发生的现象是有水喷出.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com