
 金属及其制品是现代生活中常见的材料,请回答下列问题:
金属及其制品是现代生活中常见的材料,请回答下列问题:分析 (1)根据金属的性质和用途分析;
(2)根据铁生锈的条件、氧化铝与盐酸的反应分析回答;
(3)在金属活动性顺序中,位置在前的金属能将位于其后的金属从其盐溶液中置换出来;
(4)根据金属活动性顺序表的应用分析判断.
解答 解:(1)铝、铁、铜是我们生产生活中使用比较广泛的金属.铁锅是利用金属铁的导热性;
(2)铁制品容易锈蚀,是因为铁跟空气中的氧气和水蒸气等发生了化学反应.铝具有很好的抗腐蚀性能,是因为铝在空气中能与氧气反应,其表面生成一层致密的薄膜,该反应的化学方程式为:4Al+3O2═2Al2O3.
(3)把少量铝粉和铁粉的混合物加入一定量的硝酸银溶液中,由于金属的活泼性是铝>铁>银.铝首先与硝酸银反应,生成了硝酸铝和银,当铝反应完后铁再与硝酸银反应生成了硝酸亚铁和银.若溶液变为浅绿色,说明了铝全部参加了反应,铁也与硝酸银发生了.则此时,溶液中一定含有Fe(NO3)2、Al(NO3)3,可能含有AgNO3.
(4)①铝能与硫酸亚铁溶液反应生成铁,说明铝>铁,铜不能与硫酸亚铁溶液反应,说明铁铁>铜,可以证明其活动性顺序为铝>铁>铜,故A正确;
②铁丝不能与硫酸铝溶液反应,说明铝>铁,铁丝能与硫酸铜溶液反应,说明铁>铜,可以证明其活动性顺序为铝>铁>铜,故B正确;
③铝丝、铁丝都能硫酸铜溶液反应,说明铝、铁的活泼性大于铜,但不能比较铝、铁的活泼性,故C错误;
④铜不能与硫酸铝溶液、硫酸亚铁溶液反应,说明铝、铁的活泼性大于铜,但不能比较铝、铁的活泼性.故D错误.
故答为:(1)A;(2)水蒸气,4Al+3O2═2Al2O3;(3)Fe(NO3)2、Al(NO3)3;(4)①②.
点评 同学们要会利用金属活动顺序表设计实验,去验证金属的活动性强弱.氢前边的金属会与稀硫酸、盐酸反应,但氢后边的金属不会与稀硫酸、盐酸反应,前边的金属会把后边的金属从其盐溶液中置换出来.


科目:初中化学 来源: 题型:解答题
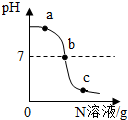 已知M、N分别是稀盐酸、氢氧化钠溶液中的一种.某化学兴趣小组同学在一定量的M中不断滴加N,并测定所得溶液的pH值,如图所示.
已知M、N分别是稀盐酸、氢氧化钠溶液中的一种.某化学兴趣小组同学在一定量的M中不断滴加N,并测定所得溶液的pH值,如图所示.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 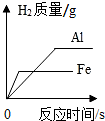 等质量的铁片、铝片分别与足量且质量分数相同的稀硫酸反应 | |
| B. |  向H2SO4和MgSO4的混合溶液中滴加NaOH溶液 | |
| C. | 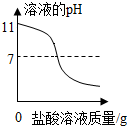 向pH=11的NaOH溶液中不断加稀盐酸 | |
| D. | 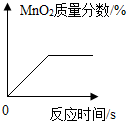 加热KClO3和MnO2的混合物 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
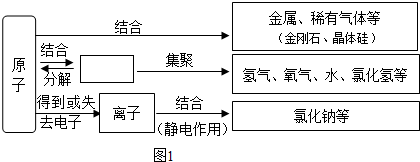
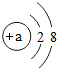 当a=8时,该粒子是阴离子(填“原子”、“阳离子”或“阴离子”).
当a=8时,该粒子是阴离子(填“原子”、“阳离子”或“阴离子”).
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 202g | B. | 256g | C. | 252g | D. | 不能确定 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
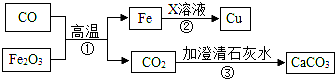
| A. | 反应①中CO发生氧化反应 | |
| B. | 反应②的化学方程式是:Fe+Cu(OH)2=Cu+Fe(OH)2 | |
| C. | X溶液可能是硫酸铜溶液 | |
| D. | 反应③可以检验二氧化碳气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com