解:(1)100g溶质质量分数为12.5%的NaCl溶液的步骤:计算、称量(量取)、溶解、装瓶贴签,用图示的序号表示为:④②①⑤③.
(2)图③中玻璃棒用于溶解时的搅拌,促进溶解.
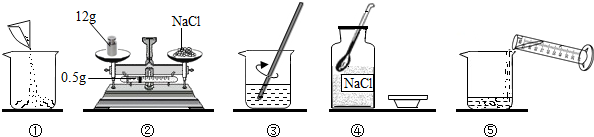
(3)溶质质量=溶液质量×溶质的质量分数,配制100g溶质质量分数为12.5%的NaCl溶液,需氯化钠的质量=100g×12.5%=12.5g;溶剂质量=溶液质量-溶质质量,则所需蒸馏水的质量=100g-12.5g=87.5g;水的密度为1g/cm
3,则根据V=
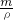
=

=87.5cm
3=87.5mL,故应选用100mL的量筒.
(4)托盘天平的使用要遵循“左物右码”的原则,图②中氯化钠与砝码的位置颠倒;由左盘的质量=右盘的质量+游码的质量可知:砝码质量=药品质量+游码的质量,所以药品质量=砝码质量-游码质量,即药品质量=12g-0.5g=11.5g.
故答案为:(1)④②①⑤③;(2)搅拌促进溶解;(3)100;(4)图②中氯化钠与砝码的位置颠倒;图④瓶盖没有倒放;11.5.
分析:(1)根据配制溶质质量分数一定的溶液的基本步骤进行分析解答.
(2)根据配制溶质质量分数一定的溶液中玻璃棒的作用进行分析解答.
(3)利用溶质质量=溶液质量×溶质的质量分数,可根据溶液的质量和溶质的质量分数计算配制溶液所需要的溶质的质量;再根据溶剂质量=溶液质量-溶质质量即可求得蒸馏水的质量、体积,进而可确定所需量筒的量程.
(4)托盘天平的使用要遵循“左物右码”的原则,如果位置放反,根据左盘的质量=右盘的质量+游码的质量,列等式进行计算.
点评:本题难度不大,明确配制一定溶质质量分数的溶液实验步骤、所需的仪器与作用等是正确解答本题的关键.

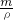 =
= =87.5cm3=87.5mL,故应选用100mL的量筒.
=87.5cm3=87.5mL,故应选用100mL的量筒.

 习题精选系列答案
习题精选系列答案