
| 73 |
| x |
| 117 |
| y |
| 44 |
| 8.8g |
| 14.6g |
| 20% |
| 73g |
| 1.1g/cm3 |
| 23.4g |
| 144.2g |


 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:初中化学 来源: 题型:
| 温度/℃ | 1 0℃ | 20℃ | 40℃ | 60℃ |  | |
| 溶解度 /g |
NaCl | 35.8 | 36.0 | 36.6 | 3 7.3 | |
| KNO3 | 20.9 | 3 1.6 | 63.9 | 1 10 | ||
查看答案和解析>>
科目:初中化学 来源: 题型:
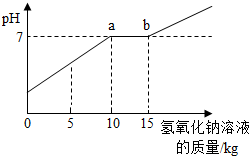 (2009?荆门)通常在实验室做完“氢气的制取”实验后,要将废液倒入废液桶中,这样就可收集一些硫酸和硫酸锌的混合溶液(不考虑其他杂质).为避免污染环境,某校化学兴趣小组的同学做了如下实验:
(2009?荆门)通常在实验室做完“氢气的制取”实验后,要将废液倒入废液桶中,这样就可收集一些硫酸和硫酸锌的混合溶液(不考虑其他杂质).为避免污染环境,某校化学兴趣小组的同学做了如下实验:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com