
【题目】Ⅰ.下列是实验室制取气体的一些装置图,请根据要求回答:
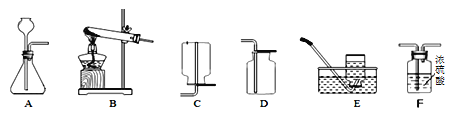
(1)实验室用高锰酸钾做原料制氧气的化学方程式为____________,可选用的发生装置是_______________(填字母序号)。
(2)实验室制取并收集一瓶干燥的二氧化碳气体,化学反应方程式为______________。按照气流自左至右方向流动,所用仪器按连接顺序依次为______________(填字母顺序)。
(3)实验室若用5%的过氧化氢溶液与二氧化锰混合来制取氧气。要配制5%的过氧化氢溶液600g,需要质量分数为30%的过氧化氢溶液(密度为1.1g/cm3)________mL(计算结果保留一位小数)。稀释过氧化氢溶液的主要步骤有:计算、_____________、稀释、装瓶并贴标签。
Ⅱ.下列是某化学小组探究物质组成与性质的实验装置图,根据要求回答:

(1)上述实验设计中有错误的是_____________(填字母序号),A中可燃物应取过量的原因是___________。
(2)B中玻璃棒搅拌的目的是_____________,C中会出现的实验现象为______________。
(3)D中硬质玻璃管内发生反应的化学方程式为________________,酒精灯的作用是_________。
【答案】 2KMnO4![]() K2MnO4+ MnO2+ O2↑ B CaCO3+2HCl== CaCl2+H2O+ CO2↑ AFD 90.9mL 量取 AB 将广口瓶内氧气全部耗尽 散热 U型管内液面a高b低 略 消除尾气
K2MnO4+ MnO2+ O2↑ B CaCO3+2HCl== CaCl2+H2O+ CO2↑ AFD 90.9mL 量取 AB 将广口瓶内氧气全部耗尽 散热 U型管内液面a高b低 略 消除尾气
【解析】(1)高锰酸钾在加热条件下分解生成锰酸钾、二氧化锰、氧气,化学方程式为2KMnO4![]() K2MnO4+ MnO2+ O2↑;(2). 实验室常用石灰石和盐酸制取二氧化碳,是固液常温型,选发生装置A;用盛有浓硫酸的F装置干燥。二氧化碳的密度比空气的大,用装置D收集。所用仪器按连接顺序依次为AFD;(3)稀释过程中溶质的质量分数不变,设需要质量分数为30%的过氧化氢溶液的体积为v, 5%×600g=30%=v×1.1g/cm3×30% v=90.9mL ;稀释过氧化氢溶液的主要步骤有:计算、量取、稀释、装瓶并贴标签。Ⅱ.(1) 上述实验设计中有错误的是AB测定空气中氧气含量的原理是,利用物质与空气中的氧气反应,又不生成气体,使瓶内气体减 少,压强变小,水倒流入集气瓶内,倒流的水的体积就等于瓶内氧气的体积。木炭燃烧会生成气体,所以不能用于测定空气中氧气的含量;稀释浓硫酸时应将浓硫酸沿器壁慢慢注入水中,切不可将水注入浓硫酸里,否则会导致酸液飞溅。可燃物应取过量的原因是使装置内氧气被消耗更充分反应,测定结果更准确;(2)浓硫酸溶于水会放出大量的热,B中玻璃棒搅拌的目的是使热量及时扩散,防止液体沸腾导致酸液飞溅,C中会出现的实验现象为铁生锈,并且由于生锈消耗氧气,使装置内氧气的量减少,压强变小,所以U型管内液面a高b低;(3)D中硬质玻璃管内发生反应的化学方程式为3CO+Fe2O3高温2Fe+3CO2,酒精灯的作用是点燃尾气中的一氧化碳,防止污染空气;
K2MnO4+ MnO2+ O2↑;(2). 实验室常用石灰石和盐酸制取二氧化碳,是固液常温型,选发生装置A;用盛有浓硫酸的F装置干燥。二氧化碳的密度比空气的大,用装置D收集。所用仪器按连接顺序依次为AFD;(3)稀释过程中溶质的质量分数不变,设需要质量分数为30%的过氧化氢溶液的体积为v, 5%×600g=30%=v×1.1g/cm3×30% v=90.9mL ;稀释过氧化氢溶液的主要步骤有:计算、量取、稀释、装瓶并贴标签。Ⅱ.(1) 上述实验设计中有错误的是AB测定空气中氧气含量的原理是,利用物质与空气中的氧气反应,又不生成气体,使瓶内气体减 少,压强变小,水倒流入集气瓶内,倒流的水的体积就等于瓶内氧气的体积。木炭燃烧会生成气体,所以不能用于测定空气中氧气的含量;稀释浓硫酸时应将浓硫酸沿器壁慢慢注入水中,切不可将水注入浓硫酸里,否则会导致酸液飞溅。可燃物应取过量的原因是使装置内氧气被消耗更充分反应,测定结果更准确;(2)浓硫酸溶于水会放出大量的热,B中玻璃棒搅拌的目的是使热量及时扩散,防止液体沸腾导致酸液飞溅,C中会出现的实验现象为铁生锈,并且由于生锈消耗氧气,使装置内氧气的量减少,压强变小,所以U型管内液面a高b低;(3)D中硬质玻璃管内发生反应的化学方程式为3CO+Fe2O3高温2Fe+3CO2,酒精灯的作用是点燃尾气中的一氧化碳,防止污染空气;


科目:初中化学 来源: 题型:
【题目】下列各物质按照单质、氧化物、混合物的顺序排列的是
A. 冰、干冰、食醋 B. 氮气、氧气、空气
C. 水银、水、大理石 D. 金刚石、高锰酸钾、5%的过氧化氢溶液
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲烷和水反应可以制水煤气(混合气体),其反应的微观示意图如图所示:
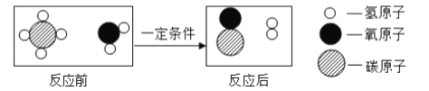
根据以上微观示意图得出的结论中,正确的是( )
A. 反应前后各元素的化合价均不变
B. 水煤气的成分是一氧化碳和氢气
C. 该反应中含氢元素的化合物有3种
D. 该反应的化学方程式中,两种生成物的计量数之比为1:1
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是水的电解实验装置图.
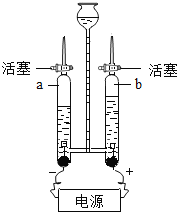
(1)该实验中,与两个电极相连的a、b两支玻璃管中产生的气体分别是 和 ,体积比约为 .
(2)该实验证明了水是由 组成的.
(3)下列行为,不利于保护水资源的是 (填序号).
A.工业用水重复使用
B.大量使用化肥和农药
C.加强城市污水处理系统的建设
D.用喷灌方法给农作物浇水
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】将10.0%的NaOH溶液逐滴加入到50 g稀盐酸中,得到混合液的温度与加入NaOH溶液的质量关系如图。下列说法正确的是
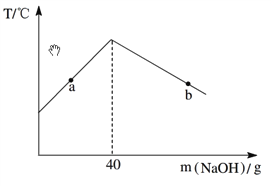
A. a点时的混合液能与Fe发生置换反应
B. b点时的混合液能与Mg(NO3)2发生两种复分解反应
C. 加入40 g NaOH溶液时混合液pH>7
D. 稀盐酸中HCl的质量分数为3.65%
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列说法中正确的是
A.木炭燃烧后生成黑色固体 B.铁丝伸入盛有氧气的集气瓶中剧烈燃烧
C.红磷在空气中不能燃烧 D.硫燃烧后生成有刺激性气味的气体
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我国制碱工业的先驱——侯德榜探索发明了“侯氏制碱法”,其生产过程涉及的主要化学反应如下:
①NH2+CO2+X=NH4HCO3
②NH4HCO3+NaCl=NH4Cl+NaHCO3↓
③2NaHCO3![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
请回答下列问题:
(1)反应①中X的化学式为 。
(2)除去混在Na2CO3粉末中少量的NaHCO3的方法是 。
(3)工业纯碱中含有氯化钠,取55g工业纯碱,向其中加入269.5g稀盐酸,恰好完全反应,生成22g二氧化碳,求:
①工业纯碱中碳酸钠的质量分数。(计算结果保留到0.1%)
②反应后溶液中溶质的质量分数。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com