
.已知某反应的化学方程式为:3NO2+H2O=2HNO3+X,则X化学式是( )
A.N2O5 B.N2 C.NO D.N2O3
科目:初中化学 来源: 题型:阅读理解
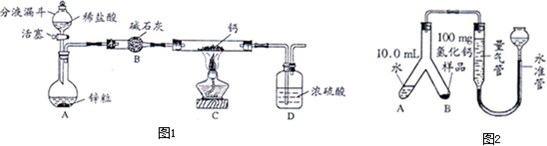
| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:
| ||
| ||
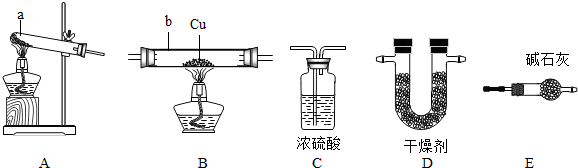
| 猜 想 | 简 要 实 验 方 案 | 现 象 | 结 论 |
查看答案和解析>>
科目:初中化学 来源:2011-2012学年江西省抚州市教研室九年级上学期期末化学试卷 题型:探究题
探究性实验是验证化学理论的一种主要方式,也展示了化学的无穷魅力。
【提出问题】催化剂能加快反应速率,但自身质量和化学性质不变。
【查阅资料】①已知KClO3分解产生氧气和KCl; ②KClO3和KCl都能溶于水,MnO2难溶于水;③MnO2与浓盐酸在加热时能产生黄绿色的Cl2.
【设计实验】
实验一、取两份质量相等(约5克)的KClO3分别放入两只大试管(分别标记A和B)中,往B试管中加入质量为1.0克MnO2的,然后按图所示组装好仪器,加热。结果发现加了MnO2的装置收集满一集气瓶的气体所用的时间要少。

实验二、待装置完全冷却之后,将B管中物质置于烧杯中加水溶解、过滤;再将滤出物干燥、称量得质量约为1.0克。
实验三 、取少量滤出物与浓盐酸置于反应装置中(放在通风橱中),加热;有黄绿色气体产生。根据以上实验回答下列问题:
(1)实验一说明加了MnO2之后,KClO3分解的速率更快,写出这一反应的化学方程式:
;如何验证集气瓶中的气体为氧气 。
(2)通过上述三个实验能说明 。
(3)某同学用KClO3和KMnO4的混合物加热,发现产生氧气的速度也很快,该同学就断定KMnO4在KClO3分解反应中也能起催化作用,你认为这同学的判断对吗? ;为什么? 。
27.(每空1分,7分) 某化学兴趣小组的同学为了探究Mg、Cu、Fe的金属活动性顺序开展了一下以下探究活动。
(1)进行试验,获得结论。完成如下实验报告,并回答有关问题。
|
|
实验方案 |
实验现象 |
实验结论 |
|
方 案 一 |
将Fe丝浸入CuSO4溶液中 |
Fe丝表面有红色物质析出 |
金属活动性:Fe_ _Cu(填“>”或“<”)该反应的反应类型属于 ____________反应。 |
|
方 案 二 |
将Mg和Cu分别在空气中灼烧 |
发现镁能剧烈燃烧,而另一种不能 |
金属活动性:Mg_ _Cu(填“>”或“<”) |
|
方 案 三 |
分别将Mg和Fe放入_________中,观察现象 |
观察到_ (填元素符号)产生气泡的速度较慢 |
金属活动性顺序:Mg>Fe |
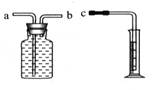 (2)反思与交流。经过讨论,该小组同学一致认为:比较金属与酸反应产生氢气的快慢,有两种测定方法:
(2)反思与交流。经过讨论,该小组同学一致认为:比较金属与酸反应产生氢气的快慢,有两种测定方法:
方法1是在相同时间内测量氢气体积的大小。若用右图所示装置测量,则接口c应与______(填“a”或“b”)相连。
方法2是测定产生相同体积氢气时_____________________。
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 NH3↑+CO2↑+H2O;②2NH3+H2SO4=(NH4)2SO4;③2NH3+3CuO
NH3↑+CO2↑+H2O;②2NH3+H2SO4=(NH4)2SO4;③2NH3+3CuO 3Cu+N2+3H2O;④氨气密度小于空气,极易溶于水,具有强烈的刺激性气味,是空气的污染物之一.
3Cu+N2+3H2O;④氨气密度小于空气,极易溶于水,具有强烈的刺激性气味,是空气的污染物之一.
| 猜 想 | 简 要 实 验 方 案 | 现 象 | 结 论 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
探究性实验是验证化学理论的一种主要方式,也展示了化学的无穷魅力。
【提出问题】催化剂能加快反应速率,但自身质量和化学性质不变。
【查阅资料】①已知KClO3分解产生氧气和KCl;②KClO3和KCl都能溶于水,MnO2难溶于水;③MnO2与浓盐酸在加热时能产生黄绿色的Cl2.
【设计实验】
实验一、取两份质量相等(约5克)的KClO3分别放入两只大试管(分别标记A和B)中,往B试管中加入质量为1.0克MnO2的,然后按图所示组装好仪器,加热。结果发现加了MnO2的装置收集满一集气瓶的气体所用的时间要少。
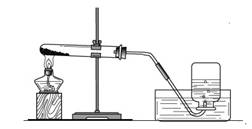
实验二、待装置完全冷却之后,将B管中物质置于烧杯中加水溶解、过滤;再将滤出物干燥、称量得质量约为1.0克。
实验三 、取少量滤出物与浓盐酸置于反应装置中(放在通风橱中),加热;有黄绿色气体产生。根据以上实验回答下列问题:
(1)实验一说明加了MnO2之后,KClO3分解的速率更快,写出这一反应的化学方程式:
;如何验证集气瓶中的气体为氧气 。
(2)通过上述三个实验能说明 。
(3)某同学用KClO3和KMnO4的混合物加热,发现产生氧气的速度也很快,该同学就断定KMnO4在KClO3分解反应中也能起催化作用,你认为这同学的判断对吗? ;为什么? 。
27.(每空1分,7分) 某化学兴趣小组的同学为了探究Mg、Cu、Fe的金属活动性顺序开展了一下以下探究活动。
(1)进行试验,获得结论。完成如下实验报告,并回答有关问题。
|
| 实验方案 | 实验现象 | 实验结论 |
| 方 案 一 | 将Fe丝浸入CuSO4溶液中 | Fe丝表面有红色物质析出 | 金属活动性:Fe_ _Cu(填“>”或“<”)该反应的反应类型属于 ____________反应。 |
| 方 案 二 | 将Mg和Cu分别在空气中灼烧 | 发现镁能剧烈燃烧,而另一种不能 | 金属活动性:Mg_ _Cu(填“>”或“<”) |
| 方 案 三 | 分别将Mg和Fe放入_________中,观察现象 | 观察到_ (填元素符号)产生气泡的速度较慢 | 金属活动性顺序:Mg>Fe |
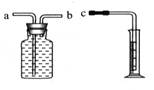 (2)反思与交流。经过讨论,该小组同学一致认为:比较金属与酸反应产生氢气的快慢,有两种测定方法:
(2)反思与交流。经过讨论,该小组同学一致认为:比较金属与酸反应产生氢气的快慢,有两种测定方法:
方法1是在相同时间内测量氢气体积的大小。若用右图所示装置测量,则接口c应与______(填“a”或“b”)相连。
方法2是测定产生相同体积氢气时_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com