
| 实验编号 | 实验目的 | 温度 | 催化剂 | 浓度 |
| 甲组实验Ⅰ | 探究浓度对H2O2分解速率的影响 | 25℃ | 二氧化锰 | 10mL 2% H2O2 |
| 甲组实验Ⅱ | 25℃ | 二氧化锰 | 10mL 5% H2O2 |
分析 (1)根据气密性检验的原则是先让装置和水构成封闭的整体,改变某一条件使压强发生改变来判断气密性的好坏进行分析;
(2)对照实验要控制只能有一个变量,此变量为H2O2的浓度,则催化剂应保持一致;
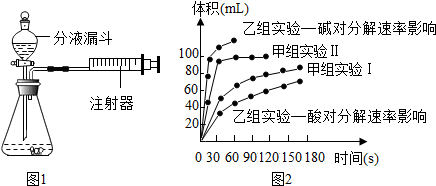
(3)①在体积-时间图,斜率即可代表化学反应速率;
②由乙组研究的酸、碱对H2O2分解影响因素的数据分析可知碱性越强,由图可知碱性强分解速率越快.
解答 解:(1)气密性的检验是根据压强原理,可以关闭分液漏斗活塞,将注射器外移看停止用力后看注射器活塞能够复原,也可固定注射器活塞,采用液面差法,也可用升高温度法,故选C;
(2)由甲组两个实验对比可以看出实验Ⅱ中催化剂与实验Ⅰ中的相同,而过氧化氢浓度不同,因此甲组的实验目的为探究浓度对速率的影响;
(3)①由图象可知在体积-时间图,斜率即可代表化学反应速率,由甲组实验两条曲线可知,甲组实验Ⅱ斜率大,因此H2O2的浓度越大分解速率越快,
②由乙组研究的酸、碱对H2O2分解影响因素的数据分析可知碱性越强,放出气体的速率越快,由题意知Ba02固体与H2SO4溶液反应制H202的反应物为Ba02和H2SO4,产物为H202,根据原子守恒可知另一种产物为硫酸钡,即:Ba02+H2SO4=H202+BaSO4↓,由图可知酸性条件下,H202分解的速率慢.
故答案为:(1)C;
(2)浓度;
(3)①越快;
②碱性;BaO2+H2SO4=BaSO4↓+H2O2,过氧化氢在酸性环境下分解较慢.
点评 本题考查外界因素对化学反应速率的影响,涉及气密性的检验方法主要有三个,则答案不唯一,但原则都是先让装置和水构成封闭的整体,改变某一条件使压强发生改变来判断气密性的好坏,此题综合性较强,难度适中.


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:初中化学 来源: 题型:选择题
| A. | 实验室用稀硫酸和大理石制取二氧化碳 | |
| B. | 用稀硫酸除去氯化钠溶液中的少量碳酸钠 | |
| C. | 用锌片和氯化铜溶液验证金属锌比铜活泼 | |
| D. | 滴加氯化钡试剂产生白色沉淀证明溶液一定是硫酸 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| OH- | Cl- | CO32- | |
| H+ | / | 溶 | 溶 |
| Ba2+ | 溶 | 溶 | 不溶 |
| Na+ | 溶 | 溶 | 溶 |
| 实验步骤 | 实验现象 | 结论及解释 |
| 步骤一:取少量待测溶液于试管中,向其中滴加足量的稀盐酸 | 有气泡产生 | 猜想(1)不成立,写出有关反应化学方程式Na2CO3+2HCl═2NaCl+H2O+CO2↑ |
| 步骤二:取少量待测溶液于试管中,然后滴加足量的BaCl2溶液,静置,向上层清液中滴加酚酞 | 有沉淀产生,溶液不变红(或溶液变红) | 猜想(2)或(3)成立,写出有关反应化学方程式BaCl2+Na2CO3═BaCO3↓+2NaCl |
查看答案和解析>>
科目:初中化学 来源: 题型:多选题
| A. | 同温度同质量液态水和玻璃态水,体积相同 | |
| B. | 玻璃态水不属于氧化物 | |
| C. | 玻璃态水和普通水的化学性质相同 | |
| D. | 玻璃态水分子不运动 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验操作 | 实验现象 | 实验结论 |
| 用试管取该溶液1-2mL,滴入1-2滴无色酚酞试液,振荡 | 无色酚酞试液变红色 | 溶液呈碱性 |
| 无色酚酞试液不变色 | 溶液呈酸性或中性. |
查看答案和解析>>
科目:初中化学 来源:江苏省教育集团树人学校2017届九年级下学期第二次模拟考试化学试卷 题型:选择填充题
洗发产品中含有的枸橼酸(C6H8O7)能使头发柔顺有弹性且气味清香。下列关于枸橼酸的说法中正确的是
A. 枸橼酸是由6个碳原子、8个氢原子和7个氧原子构成的
B. 枸橼酸属于氧化物
C. 枸橼酸中氧元素的质量分数最大
D. 枸橼酸中碳、氢、氧三种元素的质量比为6:8:7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com