
【题目】将下列物质加入足量的水中,能形成无色透明溶液的是(____)
A硫酸铜。
B食盐
C硫酸亚铁
D_____
科目:初中化学 来源: 题型:
【题目】维生素C (C6H8O6)对人体皮肤和牙龈健康有重要作用,缺乏维生素C会引起坏血病,中学生每天需要补充约60mg维生素C。请回答下列问题: (写出计算过程)
(1)维生素C中碳、氧元素的质量比是___________。
(2)维生素C的相对分子质量是________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】金是金属活动性顺序中排在最后的一种金属,金元素的相关信息如下。
下列有关金的说法正确的是( )
A.金元素属于非金属元素
B.金原子的原子序数为79
C.金原子原子核外电子数为197
D.金容易失去最外层的电子形成阳离子
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】网上报道某公司非法使用草甘膦转基因大豆。草甘膦的化学式(C3H8NO5P)是一种有机磷除草剂,白色晶体,易溶于水、乙醇等,不可燃,常温下稳定。计算;
(1)一个草甘膦分子中含有的原子个数为
(2)草甘膦中元素的质量比为C:H:O
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列选项中物质的名称、俗名、化学式、类别完全一致的是( )
A.氧化钙 消石灰 CaO 氧化物B.氢氧化钠 烧碱 NaOH 碱
C.乙醇 酒精 C2H5OH 氧化物D.氢氧化钙 石灰石 Ca(OH)2 碱
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在实验课上,同学们将CO2通入到Ca(OH)2溶液中观察到有白色沉淀生成,而将CO2通入到NaOH溶液中无明显现象。
【提出问题】CO2与NaOH溶液是否发生了化学反应?
【提出猜想】CO2与NaOH溶液发生了化学反应
【实验探究】小明设计出了下列4种实验装置,其共同原理是二氧化碳和氢氧化钠溶液反应,使容器内压强降低。
(1)实验现象为:A中试管内液面上升,B中 , C中 , D中水槽中的水部分进入烧瓶。
(2)小宁对小明的方案提出了质疑,他认为小明的实验不严谨,其理由是要得到科学严谨的结论,利用方案A,补做的对比实验是。
(3)小丽的改进方案是利用反应后的溶液来验证猜想,请完成实验报告。
实验操作 | 实验现象 | 实验结论 |
向实验后的溶液中加入稀盐酸 | 猜想正确 |
(4)【得出结论】CO2与NaOH溶液发生了化学反应,请写出CO2与NaOH反应的化学方程式:。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】铁、铜是我们生活中重要的金属材料。
(1)电路中经常用铜作导线,这是利用了铜的_______性。
(2)工业上用一氧化碳和赤铁矿(主要成分是氧化铁)冶炼铁,发生的化学方程式是______________
(3)将油漆涂在铁艺家具上以防止生锈,其目的是将铁与空气中的______、_______隔绝。
(4)矿物的储量有限,而且不可再生。我们需要保护金属资源并进行金属的回收利用。欲从含有硫酸、硫酸亚铁和硫酸铜的废液中,回收全部铜。处理过程如下:步骤①加入过量铁粉,写出发生反应的其中一个化学方程式____________________________ 该反应的基本反应类型是_________ 反应,充分反应后步骤②进行的操作是__________,得到的滤渣中含有_______ ,继续处理可以得到纯净的金属铜和硫酸亚铁固体。
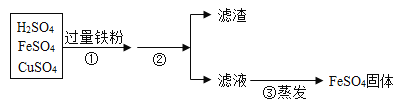
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】锌是人体必需的的微量元素,称“生命元素”。
(1)【锌的广泛应用】
处于生长发育期的儿童、青少年如果缺锌,会导致发育不良,食欲差,反应迟钝。缺乏严重时,将会导致“ 症”和智力发育不良。 补“锌”采用药补与食补并举,经常吃贝壳类海产品、红色肉类等含锌的食物有利补“锌”,这个“锌 ”指。
A. 单质 B. 元素 C. 原子 D. 分子
(2)实验室用锌与稀硫酸制取氢气,同时得到副产品硫酸锌。反应的化学方程式为。
(3)【制备七水硫酸锌】
以含锌废渣(主要成分为ZnO,杂质为FeO﹑CuO)为原料制备七水硫酸锌(ZnSO4·7H2O)的流程如下。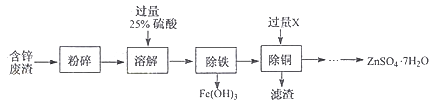
粉碎的目的是。
(4)若实验室用质量分数为98%,密度为1.84g/ml的浓硫酸配制200g、25%的稀硫酸,需要浓硫酸的体积为(精确到小数点后一位),配制时,需要的玻璃仪器有量筒﹑玻璃棒、烧杯和 ,
(5)物质X是 , 滤渣中含有的金属单质有 ,
(6)流程中获得七水硫酸锌前省略的操作是﹑冷却结晶﹑过滤、洗涤和低温烘干。
(7)某温度下,Fe(OH)3分解得到一种铁﹑氧质量比21:8的氧化物,该氧化物的化学式。
(8)除铁过程中,温度、pH对除铁效果的影响分别对如图所示。由图可知,除铁时温度应控制在℃为宜,pH应控制在为宜。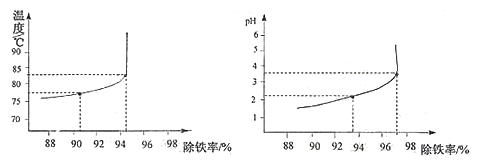
(9)【组成测定】在一定条件下,向ZnSO4溶液中加入Na2CO3溶液,充分反应后,经过滤、洗涤、低温干燥得到纯净滤渣aZnCO3·bZn(OH)2·cH2O。为了确定aZnCO3·bZn(OH)2·cH2O组成,进行如下实验: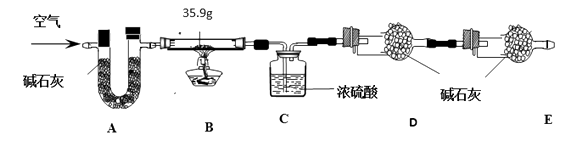
【查阅资料】(假设每步反应、吸收均完全。碱石灰为氢氧化钠和生石灰的混合物。)
aZnCO3·bZn(OH)2·cH2O受热分解生成ZnO、H2O、CO2三种产物,
其中ZnCO3 ![]() ZnO+CO2↑;Zn(OH)2
ZnO+CO2↑;Zn(OH)2 ![]() ZnO+H2O。
ZnO+H2O。
现称取35.9 g aZnCO3·bZn(OH)2·cH2O在B装置中进行煅烧,将完全煅烧过程中产生的气体依次通过装置C和装置D,它们分别增重7.2 g和4.4 g。
【实验分析及数据处理】
装置A的作用是。
(10)若没有E装置,测得二氧化碳的质量(填“偏大”、“偏小”或“无影响”)。
(11)根据上述数据,化学式a ZnCO3·b Zn(OH)2· c H2O中的a:b:c = 。
(12)【反思与拓展】
滤渣成分因温度等不同导致a、b、c会有差异,假设B化学式为ZnCO3·2Zn(OH)2·H2O,向该B中加入稀硫酸,反应的化学方程式为:。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com