
下列为实验室常用的实验装置示意图,请回答下列问题:
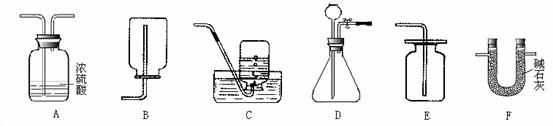
(1)若实验室需制取干燥的CO2气体,你选择的干燥装置是 (写装置编号,下同),
收集装置是 ;
(2)若实验室制取的X气体只适用B装置进行收集,请推测X气体一条可能的性质:
;
(3)D装置在装药品之前需检查气密性。在不与其他装置连接时,请说明其检验方法及气密性良好的标志 。
【答案】 1)A E (2) 密度比空气小或能溶于水
(3)用弹簧夹(或止水夹)夹紧胶皮管,从长颈漏斗中加水至使长颈中形成一段水柱,若在一段时间内水柱液面不下降,则该装置的气密性良好。
【解析】此题是一道综合的实验探究题。若实验室需制取干燥的CO2气体,选择的干燥装置是A,不能用F,因为碱石灰会和二氧化碳反应;实验室制取的X气体只适用B装置进行收集,则该气体密度比空气小或能溶于水;D装置在装药品之前需检查气密性。在不与其他装置连接时,其检验方法及气密性良好的标志用弹簧夹(或止水夹)夹紧胶皮管,从长颈漏斗中加水至使长颈中形成一段水柱,若在一段时间内水柱液面不下降,则该装置的气密性良好。


科目:初中化学 来源: 题型:
隔夜菜是否能吃,主要在于烧熟后的隔夜菜中亚硝酸盐含量的变化是否符合食品安全要求。蔬菜中的硝酸盐来自生长过程中所施氮肥。空气中的微生物(如硝酸盐还原菌)进入到蔬菜中,会产生一种还原酶,使蔬莱中的部分硝酸盐还原成亚硝酸盐。烧熟后的菜在食用和保存阶段都会有一些细菌进入;做熟的菜更适合细菌生长。某研究小组对烧熟的菜中亚硝酸盐含量做了测试,下表为盖有保鲜膜的菜肴在4℃的冰箱中放置不同时间的亚硝酸盐含量(单位:mg·kg-1)
| 菜肴 | 半小时 | 6小时 | 18小时 | 24小时 |
| 炒青菜 | 0.686 1 | 0.768 2 | 4.333 3 | 5.362 4 |
| 韭菜炒蛋 | 1.815 3 | 1.924 9 | 2.839 0 | 5.630 6 |
| 红烧肉 | 2.495 6 | 4.255 8 | 4.366 8 | 5.518 8 |
| 红烧鲫鱼 | 2.094 8 | 3.230 0 | 7.239 7 |
将一份红烧鲫鱼样本(不盖保鲜膜)在常温下放置4小时,测定其亚硝酸盐含量为8.948 3 mg·kg-1。请根据以上材料,回答下列问题:
(1)亚硝 酸盐中含有
酸盐中含有 ,其中氮元素的化合价是 价;
,其中氮元素的化合价是 价;
(2)根据表中的数据,菜中的亚硝酸盐含量变化的共同规律是 ;
(3)要使烧熟后的隔夜菜中亚硝酸盐含量尽可能低,保存的条件应该是
;
(4)炒菜过程中温度一般在100℃以上,你认为从生菜炒成熟菜过程中的亚硝酸盐含量是否会持续增加 ,原因是 。
查看答案和解析>>
科目:初中化学 来源: 题型:
下列是初中化学中的一些重要实验,请回答:

(1)A中红磷必须足量的原因___________________;
(2)B中玻璃棒的作用是_______________________;
(3) C中反应后天平不平衡,该反应是否遵守质量守恒定律____(填“是”或“否)。
查看答案和解析>>
科目:初中化学 来源: 题型:
某化学兴趣小组要用80g10%的氢氧化钠溶液制作叶脉书签,下图是他配制溶液的操作示意图。

(1)称量氢氧化钠固体时,不能将氢氧化钠直接放在纸上称量的原因是____________________。
(2)配制上述溶液,下列操作失误,会引起溶质质量分数降低的是______
a用量筒取水时,仰视读数
B.将量筒中的水倒入烧杯时,有少量的水溅出
(3)一周后,该实验小组的同学整理实验时时,发现氢氧化钠固体忘记了盖瓶盖,老师告知,此瓶氢氧化钠已变质,但不知变质的程度。为此,该化学兴趣小组在老师的指导下,进行了实验。
【查阅资料】氯化钙和氯化钡溶液都呈中性。
【提出问题】①氢氧化钠变质的原因?用化学反应方程式表示_________________________-
②氢氧化钠的变质程度如何?
【实验设计】化学兴趣小组分成甲乙两组进行探究实验。
甲组的方案:取少量固体样品于烧杯中,加足量的水溶解,加入氢氧化钙溶液,知道不再产生沉淀为止,静置,滴入酚酞试液,溶液变红,证明氢氧化钠部分变质。
乙组不同意甲的方案,理由是_______________________________。
乙组方案,根据所提供的药品设计实验方案,请你完成下表。
提供的药品:酚酞试液、稀盐酸、氯化钡溶液、氯化该溶液、氢氧化钙溶液、蒸馏水
| 实验步骤 | 实验现象 | 结论 |
| a.取少量氢氧化钠固体于试管中 b.加入足量的蒸馏水完全溶解 C.__________________ d._______________ |
___________________; _____________________ | 氢氧化钠固体部分变质 |
查看答案和解析>>
科目:初中化学 来源: 题型:
碱式碳酸盐广泛应用于工农业生产。
(1)某碱式碳酸盐药品M(OH)2·MCO3,为确定金属M的相对原子质量,某研究小组设计如下实验装置及步骤(不考虑植物油中溶解CO2产生的影响)。

①连接装置并_________;②准确称量样品的质量;③装药品,调节量气装置两边液面相平,读数;④加热至样品质量不再减少;⑤冷却到室温;⑥调节量气装置两边液面相平,读数、列式计算。
I.请将上述实验步骤补充完整。
II.装置B的作用是_________,少量植物油的作用是_________,C中的试剂是_________ (填字母序号)。
a.碱石灰 b.浓硫酸 c.硫酸铜
III.步骤⑥中调节液面相平的操作是将水准管_________(填“缓慢上移”或“缓慢下移”)。
IV.若其它操作均正确,仅因下列因素可使M相对原子质量的测定结果偏大的是_________ (填字母序号)。
a.反应前量气管水面在0刻度处,反应后仰视读数
b.样品未分解完全即停止实验
c.量气管中未加植物油
(2)实际生产中的碱式碳酸铜可表示为Cu(OH)2·mCuCO3,某研究小组仍使用上述装置测定m的值,测得3组数据如下表所示。取3组数据的平均值得到CO2的体积为______mL,又已知常温常压下CO2的密度为1. 964 g/L,据此计算m的值。(写出计算m的过程,最后结果保留小数点后两位)

查看答案和解析>>
科目:初中化学 来源: 题型:
小张同学得知我国早在西汉时期,就能利用铁单质与硫酸铜溶液反应制取铜,其反应的化学方程式为 。他利用硫酸铜进行趣味实验,将浸泡了 色硫酸铜溶液的滤纸在酒精灯火焰上点燃,观察到滤纸颜色变白,由湿变干后燃烧,在燃烧后的灰烬中出现红色固体。他很好奇,进行了相关探究,请你参与并填写有关空白。
【提出问题】红色固体是什么物质?它是如何产生的?
【查阅资料】(1)温度达200℃时,CuSO4开始分解生成CuO和另一种氧化物;此反应前后各元素的化合价保持不变。
(2)温度超过1000℃时,CuO才分解生成氧化亚铜(Cu2O);Cu2O呈红色。
【作出猜想】红色固体①可能是Cu;②也可能是Cu2O;③还可能是 的混合物。
【实验探究】(1)取红色固体观察,呈亮红色;
(2)取少量红色固体于试管中,加入稀硫酸,固体不溶解,溶液仍为无色。
【分析推理】(1)请教老师后得知,如有Cu2O存在,加入稀硫酸会发生如下反应:
Cu2O+H2SO4=CuSO4+Cu+H2O
结合实验探究的现象,确定亮红色固体为 ,同时也说明滤纸燃烧时的温度低于 (填序号)。A200℃ B1000℃
(2)滤纸主要由碳、氢、氧三种元素组成的,经分析,产生红色固体的原因可能是滤纸在燃烧过程中产生的碳与分解产生的CuO发生反应,生成亮红色固体和二氧化碳,请写出该反应的化学方程式 。
【交流讨论】(1)将浸有硫酸铜溶液的滤纸点燃,刚开始不能燃烧,是因为 。
(2)此实验中,CuSO4受热分解生成CuO和 (填化学式)。
查看答案和解析>>
科目:初中化学 来源: 题型:
下图是模拟海水制盐的流程


⑴操作a的名称是 ,所需要的玻璃仪器有 (只写其中一种玻璃仪器)。
⑵为了证明第①步所加的Ca(OH)2溶液已过量,某同学取少量①反应后的上层清液,向其中继续加入Ca(OH)2溶液,若 (填实验现象),则证明Ca(OH)2溶液已过量。
⑶实验结束后,兴趣小组对滤液进行探究
【提出问题】滤液中除了含有水和氯化钠外,还含有哪些溶质?
【提出猜想】根据实验①②③的操作后,作出如下猜想
猜想一:由于在②中加入了过量的碳酸钠溶液,所以滤液中除了含有水和氯化钠外,还仅含过量的 。
猜想二:由于在①加入了过量的氢氧化钙,发生反应生成了氢氧化镁和氯化钙,所以滤液中除了含有水和氯化钠外,只含有反应生成的氯化钙。
猜想三:由于②所加的过量碳酸钠在①之后,所加的碳酸钠把①中反应生成的氯化钙和过量的氢氧化钙全部除去,所以滤液中除了含有水和氯化钠外,还含有____ 和 。
【验证猜想】
| 步骤 | 实验操作 | 实验现象 | 推断 |
| 1 | 取少量滤液于试管中,加入过量的氯化钙溶液,振荡,静置 |
| 滤液中还含有 溶质 |
| 2 | 取步骤1反应后的混合液过滤后,取滤液少量于试管中加入 (填指示剂) |
| 滤液中还含有氢氧化钠 |
【实验结论】经过兴趣小组的实验分析,推出猜想三是正确的
【反思与拓展】为了使制得的精盐水只含有水和氯化钠,步骤④的作用是除去杂质,请写出其中一个反应的化学方程式: 。如果要将精盐水继续提纯成NaCl晶体,应进行 操作。
查看答案和解析>>
科目:初中化学 来源: 题型:
初中化学教材中的一些实验如下图,请你回答下列问题:
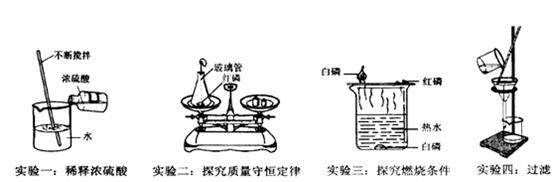 (1)实验一玻璃棒不断搅拌的目的是__________________________;
(1)实验一玻璃棒不断搅拌的目的是__________________________;
(2)实验二锥形瓶内产生的主要现象是___________________________;
(3)由实验三除了能得出可燃物燃烧的条件外,还可以比较出白磷、红磷化学性质上的不同点是___________________________________________。
(4)实验四得到的滤液仍然浑浊,原因是___________________________(答一点即可)。
查看答案和解析>>
科目:初中化学 来源: 题型:
如图1是实验室制取和收集气体的装置,根据所学知识回答下列问题:

(1)写出仪器的名称:a ;b
(2)从图1中选择装置制取并收集干燥的CO2,应选用图中的 (填字母).小彭同学设计了如图2装置并验证二氧化碳的性质,当通入二氧化碳一段时间后,F中的现象是 ;G中澄清石灰水变浑浊,反应的化学方程式为 ;H中观察到蜡烛由低到高依次熄灭,说明 .
(3)实验室若用装置E收集H2,气体应从导管的 (填“d”或“e”)端进入.
(4)若制取的O2用B装置制取的反应原理 ,用F装置排水法收集,请将图F补画完整(直接在图1中画出).
(5)化学兴趣小组为了测定石灰石样品中碳酸钙的质量分数,取25g石灰石样品放在烧杯中,然后向其中逐滴加入一定量某质量分数的稀盐酸,使之与样品充分反应(杂质不参加反应).随着反应进行,加入稀盐酸的质量与反应得到气体的质量变化关系如图3所示.请计算样品中碳酸钙的质量分数是多少?(写出计算过程)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com