某小组在实验室中用碳酸钙和稀盐酸为原料制取二氧化碳,现将一定质量的碳酸钙与100克稀盐酸混合,经充分反应后,产生二氧化碳0.25mol.问:
(1)写出有关反应的化学方程式.
(2)碳酸钙的摩尔质量是______.
(3)参加反应的碳酸钙的物质的量是多少?
(4)参加反应的盐酸溶液的质量分数是多少?
【答案】
分析:(1)根据方程式的书写方法写出方程式;(2)根据摩尔质量的计算方法计算;(3)根据方程式计算;(4)先算出溶质氯化氢的质量,再除以100g即可.
解答:解;(1)反应物是碳酸钙和盐酸,生成物是氯化钙、水、二氧化碳,用观察法配平,二氧化碳后面标上上升符号;
(2)碳酸钙的摩尔质量:40+12+16×3=100(g/mol);
(3)设参加反应的碳酸钙的物质的量是X
CaCO
3+2HCl═CaCl
2+H
2O+CO
2↑
1 1
x 0.25mol
根据
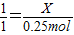
解得X=0.25mol
(4)二氧化碳的质量为:44g/mol×0.25mol=11g,设要生成11g二氧化碳,需参加反应的氯化氢质量为Y则;
CaCO
3+2HCl═CaCl
2+H
2O+CO
2↑
73 44
Y 11g
根据:
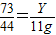
解得Y=18.25g,参加反应的盐酸溶液的质量分数是
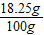
×100%=18.25%.
故答案为;(1)CaCO
3+2HCl═CaCl
2+H
2O+CO
2↑;(2)100g/mol;(3)0.25mol;(4)18.25%.
点评:解答本题的关键是弄明白物质的量、质量、摩尔质量三者的关系:质量=物质的量×摩尔质量.

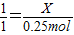 解得X=0.25mol
解得X=0.25mol 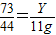 解得Y=18.25g,参加反应的盐酸溶液的质量分数是
解得Y=18.25g,参加反应的盐酸溶液的质量分数是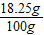 ×100%=18.25%.
×100%=18.25%.

 考前必练系列答案
考前必练系列答案