
| 反应时间 | t0 | t1 | t2 | t3 |
| 烧杯和药品的质量/g | 166.5 | 166.3 | 166.1 | 166.1 |
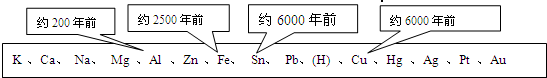
分析 (1)根据金属的用途与性质之间的关系解答.
(2)分析铝在空气中所发生的变化,解释虽然铝的活动性比铁强,但却表现出良好的抗腐蚀性的原因;
(3)利用图中数据,对比大规模开发、利用的与金属其它因素间的关系,判断与金属大规模开发、利用的先后顺序有关的因素.
(4)由已知:“用质量相等的镁粉和铝粉,分别与溶质质量分数相同、等质量的稀盐酸充分反应”,若酸完全反应,金属都剩余,则生成氢气相等,若金属完全反应,则生成氢气一定不相等.
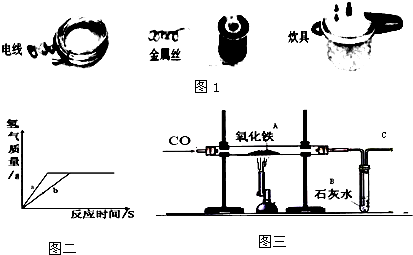
(5)回顾一氧化碳还原氯化铁的实验,回答对该实验的操作所提出的问题.
(6)由表中的实验数据可判断第四次称量时已完全反应,利用质量守恒定律,可计算放出氢气的质量;
根据化学方程式求出铁的质量,进而求出①.
解答 解:(1)金属能做成导线是因为有导电性,抽成丝是因为有延展性,做成锅是因为导热性.
(2)铝在空气中与氧气化合,在铝的表面生成致密的氧化铝薄膜(或氧化铝膜),阻止了铝进一步与氧气的接触;
(3)由图示信息可得到,金属大规模开发、利用的先后顺序跟金属的活动性有关,活动性强的金属冶炼难度大,使用则较晚;
(4)根据化学方程式:Mg+2HCl=MgCl2+H2↑;2Al+6HCl═2AlCl3+3H2↑进行计算可知:
A、因为镁的活动性比铝的活动性强,镁反应速度快,故A说法正确;
B、如果盐酸均反应完,镁恰好完全反应,铝有剩余,故B说法正确;
C、如果镁、铝都反应完,则产生的氢气一定不等,说法不正确.
D、盐酸均反应完,镁、铝都反应完,生成的氢气一定相等,故D说法正确;
故选AB
(5)一氧化碳还原氧化铁生成铁和二氧化碳,故看到的现象为固体由红变黑,澄清石灰水变浑浊,为防止生成的铁被氧化,实验结束前还要继续通一氧化碳直到冷却,故不需要断开;
(8)由质量守恒定律可知,生成氢气的质量=反应前总质量一反应后总质量=11.5+100g+55g-166.1g=0.4g
设铁的质量为x
Fe+H2SO4 =FeSO4 +H2↑;
56 2
x 0.4g
$\frac{56}{2}=\frac{x}{0.4g}$ 解得:x=11.2g
原生铁样品中铁的质量分数=$\frac{11.2g}{11.5g}$×100%=97.4%
故答案为:(1)导电性或导热性(或延展性);(2)铝的表面形成致密的氧化膜;(3)A;(4)AB;
(5)①A 固体由红变黑,B 石灰水变浑浊,②不要,气体会一直通到装置冷却,不会发生倒吸;
(6)①0.4;②原生铁样品中铁的质量分数是97.4%.
点评 本题为涉及较多的化学基础知识,题目难点不大但涉及面较广,耐心审题、沉着作答对于解答类似问题会有较大帮助.


 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:初中化学 来源: 题型:选择题
| A. | 铜加氧气加热等于氧化铜 | |
| B. | 铜和氧气生成氧化铜 | |
| C. | 2个铜和1个氧气在加热的条件下生成2个氧化铜 | |
| D. | 每128份质量的铜和32份质量的氧气在加热的条件下生成160份质量的氧化铜 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 新型的风能、太阳能路灯能“吸住太阳光”、“揽住风力”.请回答下列问题:
新型的风能、太阳能路灯能“吸住太阳光”、“揽住风力”.请回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 的垃圾箱中的是ABC(填字母序号).
的垃圾箱中的是ABC(填字母序号).
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 向一支盛少量水的试管中加入适量某固体物质,盖上玻璃片,观察到玻璃片下面有水珠,则加入的
向一支盛少量水的试管中加入适量某固体物质,盖上玻璃片,观察到玻璃片下面有水珠,则加入的查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com