
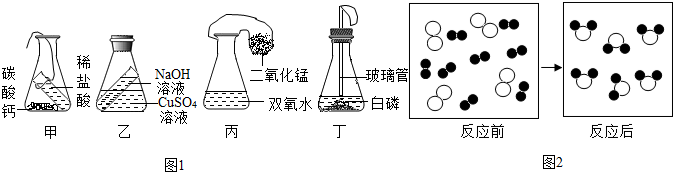
 粒子,请根据图示写出一个符合条件的化学方程式2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O.
粒子,请根据图示写出一个符合条件的化学方程式2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O. 分析 (1)做验证质量守恒定律的实验时所选用的装置应该考虑到:①如果反应物中有气体参加反应,或生成物中有气体生成,应该选用密闭装置.②如果反应物中没有气体参加生成物中也没有气体生成,装置可不考虑密闭.
(2)根据实验现象结合图示进行分析解答;
(3)由质量守恒定律的微观意义可知,即反应前后原子的种类和数目不变,在化学反应前后一定不变的是:原子种类、数目、质量据此分析即可.
(3)根据质量守恒定律的微观解释判断,反应前后原子的种类和数目不变分析判断即可;
解答 解:(1)理论上最不合理的设计是图甲,盐酸与碳酸钠反应会生成二氧化碳,装置没有密封,生成的二氧化碳气体散逸到空气中去了,所以导致天平不能平衡;如果按该同学的设计,反应后天平指针会偏右,若不改变本组药品来验证守恒定律.用图丙中的装置进行验证质量守恒定律,能达到目的,原因在于装置是密封的.故应将该组的装置按以上丙图改进最好;
(2)丙中过氧化氢溶液和二氧化锰反应产生氧气,使气球膨胀;丁中白磷燃烧放热,使气球膨胀;丙、丁两组产生的共同现象是气球膨胀;它们反应后放在天平上,发现依然会有不平衡的现象.若不考虑气密性.可能的原因是反应产生的气体使气球膨胀,因此装置受到的浮力会增大;综上分析在验证质量守恒定律时,由气体参加或生成时要保持装置密闭,体积不变;
(3)由质量守恒定律的微观意义可知,在化学反应前后一定不变的是:原子种类;原子数目;原子质量;物质的总质量,一定变化的是物质的种类或分子的种类,而分子数量有可能会发生变化.
(4)根据质量守恒定律,反应前后原子的种类和数目不变,加上两个 粒子各原子个数正好相等,从图示可以看出化学变化的实质是:分子的分开原子的重新组合.氢气在氧气中燃烧生成水,反应的化学方程式为:2H2+O2 $\frac{\underline{\;点燃\;}}{\;}$ 2H2O;
粒子各原子个数正好相等,从图示可以看出化学变化的实质是:分子的分开原子的重新组合.氢气在氧气中燃烧生成水,反应的化学方程式为:2H2+O2 $\frac{\underline{\;点燃\;}}{\;}$ 2H2O;
故答案为:
(1)甲,盐酸与碳酸钠反应会生成二氧化碳,装置没有密封,所以导致天平不能平衡. 偏右;丙;
(2)气球膨胀;反应产生的气体使气球膨胀,因此装置受到的浮力会增大;装置密闭,体积不变;
(3)②④⑤⑥;
(4)2;2H2+O2 $\frac{\underline{\;点燃\;}}{\;}$ 2H2O.
点评 在做这种类型题目时,要求学生要注意总结规律,这样学习化学,可以达到事半功倍的效果,长此以往,同学们的学习能力便会在潜移默化中得到提高.


科目:初中化学 来源: 题型:推断题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 氧化反应都是化合反应 | |
| B. | 有氧气参加的化学反应,一定是化合反应 | |
| C. | 化合反应只生成一种物质 | |
| D. | 氧化反应的生成物一定有两种 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com