
 肥田粉是常用的氮肥,如图为某品牌肥田粉的部分标签.
肥田粉是常用的氮肥,如图为某品牌肥田粉的部分标签.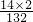 ×100%≈21.2%;
×100%≈21.2%;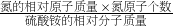 ×100%;
×100%;

 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:初中化学 来源: 题型:
 肥田粉是常用的氮肥,如图为某品牌肥田粉的部分标签.
肥田粉是常用的氮肥,如图为某品牌肥田粉的部分标签.查看答案和解析>>
科目:初中化学 来源: 题型:
 肥田粉是常用的氮肥,如图为某品牌肥田粉的部分标签,为了计算该品牌肥田粉的纯度(样品中硫酸铵的质量分数),小玉和小昊采用了两种不同的方法.
肥田粉是常用的氮肥,如图为某品牌肥田粉的部分标签,为了计算该品牌肥田粉的纯度(样品中硫酸铵的质量分数),小玉和小昊采用了两种不同的方法.| 2×N原子的相对原子质量 |
| (NH4)2SO4相对分子质量 |
| 14×2 |
| 132 |
| 100%×20.0% |
| 21.2% |
查看答案和解析>>
科目:初中化学 来源: 题型:
 肥田粉是常用的氮肥,下图为某品牌肥田粉的部分标签,为了计算该品牌肥田粉的纯度(硫酸铵的质量分数),小玉和小昊采用了两种不同的方法.
肥田粉是常用的氮肥,下图为某品牌肥田粉的部分标签,为了计算该品牌肥田粉的纯度(硫酸铵的质量分数),小玉和小昊采用了两种不同的方法.| 小玉根据标签所示的含氮量直接进行理论计算,过程如下: 解:该硫酸铵中氮元素的质量分数:
设样品中硫酸铵的质量分数为x 100%:21.2%=x:20.0% x=
|
小吴通过实验,测得有关数据然后进行计算,过程如下: 称取7.5g样品与足量的氢氧化钠固体混合加热.直到不再产生气体为止,得到纯净、干燥的氨气1.7g,该反应的化学方程式为: Ca(OH)2+(NH4)2SO4
(请你在下面帮助小吴完成计算) |
查看答案和解析>>
科目:初中化学 来源:不详 题型:问答题
| 2×N原子的相对原子质量 |
| (NH4)2SO4相对分子质量 |
| 14×2 |
| 132 |
| 100%×20.0% |
| 21.2% |

查看答案和解析>>
科目:初中化学 来源:2009年山东省中考化学试巻(解析版) 题型:解答题
| 小玉根据标签所示的含氮量直接进行理论计算,过程如下: 解:该硫酸铵中氮元素的质量分数:  设样品中硫酸铵的质量分数为x 100%:21.2%=x:20.0% x=  =94.3% =94.3% | 小吴通过实验,测得有关数据然后进行计算,过程如下: 称取7.5g样品与足量的氢氧化钠固体混合加热.直到不再产生气体为止,得到纯净、干燥的氨气1.7g,该反应的化学方程式为: Ca(OH)2+(NH4)2SO4  CaSO4+2NH3↑+2H2O CaSO4+2NH3↑+2H2O(请你在下面帮助小吴完成计算) ______ |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com