
| 实验步骤 | 实验现象 | 实验结论 |
| 取待测液加入紫色石蕊试液 | 溶液变为红色,说明显酸性,盐酸过量 | 甲同学猜想成立 |
分析 (1)浓盐酸挥发会使质量减少;浓硫酸吸水质量会增加且不会变质;石灰水与空气中的二氧化碳反应生辰碳酸钙沉淀,溶液质量会减小;烧碱溶液会与空气中的二氧化碳反应变质且导致质量增加;
(2)由题意知反应的化学方程式为Na2Cr2O7+X═2CrO3+Na2SO4+H2O,根据质量守恒定律可以知道反应前后元素种类、原子种类不变、原子数目不变,故可推测X的化学式;
(3)根据方程式的写法考虑;猜想三根据酸过量考虑;根据证明溶液显酸性,可以取待测液加入紫色石蕊试液,如果变为红色,说明显酸性,盐酸过量解答;
(4)根据稀盐酸与氢氧化钠反应生成氯化钠和水反应的化学方程式,由氢氧化钠的质量计算出反应后所得溶液中溶质氯化钠的质量,利用溶液的溶质质量分数计算公式计算溶液中溶质质量分数.
解答 解:
(1)A、食盐水放在敞口容器中一段时间后,不会变质;故错误;
B、浓硫酸具有吸水性而使质量增加,但不会发生化学变化,故错误;
C、烧碱溶液在空气中易与二氧化碳反应生成碳酸钠与水,溶液质量增加且变质,故正确;
D、石灰水能与空气中的二氧化碳反应而变质,但由于生成了碳酸钙的沉淀,导致溶液质量会减小,所以错误;
(2)根据质量守恒定律,反应前后原子种类和个数都不变,由化学方程式Na2Cr2O7+X═2CrO3+Na2SO4+H2O可知:反应前钠原子的个数是2个,反应后是2个;
反应前铬原子的个数是2个,反应后是2个;
反应前氧原子的个数是7个,反应后是11个,则其中4个包含在X中;
反应前氢原子的个数是0个,反应后是2个;
反应前硫原子的个数是0个,反应后1个;
由分析可知,每个X中含有4个氧原子、2个氢原子,1个硫原子,故化学式H2SO4.
(3)反应物是氢氧化钠和盐酸,生成物是氯化钠和水,所以方程式是:NaOH+HCl=NaCl+H2O;
【猜想与假设】
在猜想时要考虑两种物质恰好完全反应,反应物过量问题,氢氧化钠过量或盐酸过量,所以猜想三是:两种物质已恰好完全中和,溶液呈中性;
【设计实验】
证明溶液显酸性,可以取待测液加入紫色石蕊试液,如果变为红色,说明显酸性,盐酸过量;
(4)解:设生成的氯化钠质量为x
NaOH+HCl═NaCl+H2O
40 58.5
100g×8% x
$\frac{40}{100g×8%}=\frac{58.5}{x}$
x=11.7g
反应后所得溶液中溶质质量分数:$\frac{11.7g}{100g+100g}$×100%=5.85%.
答案:
(1)C;
(2)H2SO4.
(3)NaOH+HCl=NaCl+H2O;
【猜想与假设】两种物质已恰好完全中和,溶液呈中性;
【设计实验】
| 验步骤 | 实验现象 | 实验结论 |
| 取待测液加入紫色石蕊试液 | 溶液变为红色,说明显酸性,盐酸过量 | 甲同学猜想成立 |
点评 本题综合考查常见酸碱盐的物理性质和化学性质,不仅要求考虑物质是否变质,还得分析物质质量的变化.


科目:初中化学 来源: 题型:选择题
| 选项 | 物质 | 除杂试剂(足量) | 操作方法 |
| A | 二氧化碳(氯化氢) | 氢氧化钠溶液 | 气体通过盛有氢氧化钠溶液的洗气瓶 |
| B | 氯化钠(碳酸钠) | 稀硫酸 | 加入足量稀硫酸、蒸发结晶 |
| C | 二氧化锰(氯化钠) | 水 | 加入足量水溶解、过滤、洗涤、干燥 |
| D | 铜(氧化铜) | 氧气 | 通入足量氧气并加热 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 波音787,又称为“梦想客机”(英语:Dreamliner),2011年9月27日零时20分交付全日空.但在2013年1月16日,由于10天内连续出现安全故障,美国联邦航空局宣布暂时停飞所有波音787“梦想”客机.发生的七起事故原因包括电池电路起火、燃料泄漏、刹车装置故障、驾驶舱挡风玻璃出现裂痕等等.请根据相关信息回答问题:
波音787,又称为“梦想客机”(英语:Dreamliner),2011年9月27日零时20分交付全日空.但在2013年1月16日,由于10天内连续出现安全故障,美国联邦航空局宣布暂时停飞所有波音787“梦想”客机.发生的七起事故原因包括电池电路起火、燃料泄漏、刹车装置故障、驾驶舱挡风玻璃出现裂痕等等.请根据相关信息回答问题:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:多选题
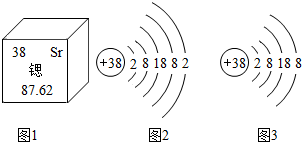 核电站中核燃料铀或钚在中子的撞击下,原子核发生分裂,产生氙、锶等原子及一些粒子和射线,同时释放大量的能量,这些能量可用于驱动汽轮机发电.锶元素在元素周期表中显示的信息和粒子结构示意图如图所示.以下表述中正确的是( )
核电站中核燃料铀或钚在中子的撞击下,原子核发生分裂,产生氙、锶等原子及一些粒子和射线,同时释放大量的能量,这些能量可用于驱动汽轮机发电.锶元素在元素周期表中显示的信息和粒子结构示意图如图所示.以下表述中正确的是( )| A. | 图a、图b都属于锶元素 | B. | 图c所表示粒子的化学符号是Sr2+ | ||
| C. | 锶原子的中子数为38 | D. | 锶原子的相对原子质量是87.62g |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 在煤炉上放一壶水防止一氧化碳中毒 | |
| B. | 用熟石灰改良酸性土壤 | |
| C. | 膨化食品袋中充入氮气既可以保鲜,还可以防止产品破碎 | |
| D. | 用白醋除热水瓶胆内的水垢 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com