
【题目】盐城的城市建设可谓是日新月异,在城市建设、生产、生活中材料有着广泛的应用。
(1)下列生活用品,主要利用金属具有良好导热性的是________(填序号),一般铜导线外面包有聚乙烯绝缘层,聚乙烯属于________材料。

(2)铁制品在空气中会发生锈蚀,其原因是铁与空气中的___________共同作用的结果。为防止钢铁制品的锈蚀,厨房中的铁锅和菜刀通常需做的防护是_____________(要求一种方法即可)。
(3)化学小组为了验证铁、铜、镁、汞的金属活动性顺序,设计了如下实验方案:
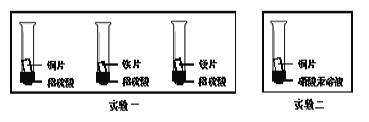
根据实验一判断出镁的金属活动性比铁强,依据的现象是___________;根据实验二的现象应得出的结论是__________。
(4)苗苗同学向含有FeSO4和CuSO4两种溶质的溶液中,加入一定质量镁粉,充分反应后过滤,滤液呈浅绿色,再向滤液中放入一枚洁净的铁钉,足够时间后取出,铁钉表面无变化。根据此现象作出了下列判断,你认为正确的是_____________(填序号)。
A. 滤纸上一定有Fe,可能有Mg、Cu
B. 滤纸上一定有Cu,可能有Fe,一定没有Mg
C. 滤液中一定有FeSO4,可能有MgSO4 、CuSO4
D. 滤液中一定有MgSO4、FeSO4,一定没有CuSO4
(5)为分析某由氧化铜和铜组成的混合物中氧化铜的质量分数,现取3份该混合物各20g,分别缓慢加入到50g、100g、150g某稀硫酸中,测得三组实验数据如表:
第I组 | 第Ⅱ组 | 第Ⅲ组 | |
稀硫酸的质量/g | 50 | 100 | 150 |
溶解固体的质量/g | 10.0 | 16.0 | 16.0 |
根据实验及有关数据进行分析与计算:
①第I组实验中反应物___________(填“氧化铜“、“稀硫酸”或“氧化铜与稀硫酸”)反应完。
②20g样品中含氧化铜的质量分数分别为____________。
③计算所用的稀硫酸溶质的质量分数为____________(写出计算过程)
④将第Ⅱ组混合物过滤,在滤液中滴加10%的NaOH溶液,画出在该混合溶液中加入10%NaOH溶液的质量与生成沉淀质量变化关系的曲线图。
 ___________________
___________________
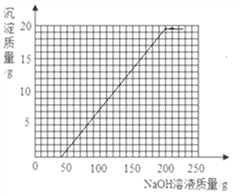
【答案】 A 合成 O2\H2O 洗净擦干(合理即可) 镁与稀硫酸反应产生气泡的速率快 Cu的活动性比Hg强 B D 稀硫酸 80% 24.5% 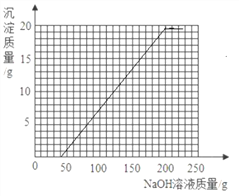
【解析】(1)铁锅主要利用金属具有良好导热性;铜导线主要利用了金属的延性和导电性;铝箔主要利用了金属的展性;铁锤主要利用金属的硬度、强度大的性质;聚乙烯属于塑料的一类,属于有机高分子合成材料;(2)铁制品在空气中会发生锈蚀,其原因是铁与空气中的氧气、水共同作用的结果。为防止钢铁制品的锈蚀,厨房中的铁锅和菜刀通常需做的防护是用完后及时擦干;(3) 金属活动顺序表:K Ca Na Mg Al Zn Fe Sn Pb H Cu Hg Ag Pt Au,在金属活动顺序表中,排在氢前边的金属能和酸发生置换反应生成盐和氢气。金属的位置越靠前,金属的活动性越强。位置靠前的金属能将位于其后的金属从它的盐溶液中置换出来。判断出镁的金属活动性比铁强,依据的现象是镁与稀硫酸反应产生气泡的速率比铁快;实验二的现象是铜的表面有银白色固体生成,溶液由无色变成蓝色,说明铜能与硝酸汞反应,应得出的结论是Cu的活动性比Hg强;(4)向含有FeSO4和CuSO4两种溶质的溶液中,加入一定质量镁粉,镁先与硫酸铜反应,然后再与硫酸亚铁反应。充分反应后过滤,滤液呈浅绿色,说明硫酸亚铁有剩余、镁粉一定完全反应;再向滤液中放入一枚洁净的铁钉,足够时间后取出,铁钉表面无变化,说明硝酸铜完全反应。故反应后溶液中的溶质有剩余的硫酸亚铁和生成的硫酸镁;固体中一定有铜,可能有铁;选BD;(1)由题中的数据分析可知,20g样品中含氧化铜的质量16g,样品中氧化铜的质量分数:16g÷20g×10%=80%;由题中数据分析知,10g氧化铜一定能将50稀硫酸中的溶质完全反应。
(2)设:稀硫酸的溶质质量分数为x
CuO+H2SO4═CuSO4+H2O
8098
10g50gx
80/10g=98/50gx
x=24.5%
答:所用稀硫酸的溶质质量分数为24.5%.
(3)设和16g氧化铜反应的稀硫酸质量为y,生成的硫酸铜的质量为z.
CuO + H2SO4 ═ CuSO4+H2O
80 98 160
16g 24.5%y z
80/98=16g/24.5%y y=80g
80/160=16g/z z=32g z=32g
设和(100g-80g)稀硫酸反应的氢氧化钠溶液的质量为m.
H2SO4 + 2NaOH=Na2SO4+2 H2O
98 80
(100g-80g)×24.5% 10%m
![]()
解得m=40g因为向有稀硫酸和硫酸铜的溶液中滴加氢氧化钠溶液时,可以看成氢氧化钠溶液先和硫酸反应,再和硫酸铜反应,所以我们得到起点坐标(40,0).
设和生成的硫酸铜反应的氢氧化钠溶液的质量为n,反应生成的沉淀的质量为w.
CuSO4 + 2NaOH = Cu(OH)2↓+Na2SO4
160 80 98
32g10%n w
![]()
解得n=160g,w=19.6g
和剩余的稀硫酸以及硫酸铜反应的氢氧化钠溶液的质量总和是40g+160g=200g,所以我们得到折点坐标(200,19.6),故绘制图象如下图.


科目:初中化学 来源: 题型:
【题目】(1)用化学用语表示:
铝原子___;二氧化氮分子___;氯化钠中的阳离子___;人体中含量最多的物质_______
(2)请用下列物质的字母序号填空:
A.硫酸铜 b.盐酸c.碳酸钠 d.熟石灰
①可用于改良土壤酸性的是 ______②侯氏制碱法制的碱_______
③用作配制波尔多液的盐___; ④可用于金属表面除锈的是_____;
(3)用化学方程式表示以下反应:
①铜和硝酸银溶液____ ②氯酸钾制氧气_______
③铁丝在纯氧中燃烧_____ ④电解食盐水得到烧碱、氯气和氢气_______
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】请结合下图回答问题:
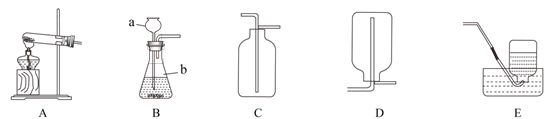
(1)标出仪器 a 的名称_____。
(2)实验室通常利用上图中_____装.置.的.组.合.制取二氧化碳(选填字母),该反应的化学方程式为_____________。
(3)选用 E 装置收集氧气的原因是_____。
(4)工业上煅烧石灰石可制得生石灰和二氧化碳。如果要制取 5.6t 氧化钙,理论上需要含 碳酸钙 80%的石灰石的质量是多少________?
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学兴趣小组的同学,为了比较金属R与铁、铜的金属活动性强弱,进行如下探究活动:
【查阅资料】铁的活动性比铜强。
【进行猜想】对三种金属的活动性顺序做出如下猜想:
猜想一:R>Fe>Cu; 猜想二:_________; 猜想三:Fe>Cu>R
【收集证据】为了验证哪一种猜想成立,甲、乙、丙三位同学分别展开实验探究。
主要操作 | 主要现象 | 实验结论 | |
甲 | 将打磨好的R丝插入盛有硫酸铜溶液的试管中 | ____________ | 猜想一正确 |
乙 | 将粗细相同打磨好的R丝、铁丝,分别插入体积和溶质质量分数都相同的稀盐酸中 | R丝表面产生气泡速率比铁丝表面产生气泡速率_________(填“快”或“慢”) | |
丙 | 将粗细相同打磨好的R丝、铁丝,分别在空气中点燃 | R丝在空气中剧烈燃烧,铁丝在空气中____________ |
写出铁丝在氧气中燃烧的化学方程式____________________。
【交流反思】三位同学交流讨论后认为,比较金属活动性强弱的方法有多种。
【归纳总结】他们总结得出比较金属活动性强弱的常见方法有:
(1)金属与氧气反应的难易和剧烈程度;
(2)金属与酸溶液是否反应或反应的剧烈程度;
(3)盒属与_________是否反应。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】玫瑰花中含有丁香油酚等,因而具有特殊的香味,丁香油酚的化学式为C10H12O2。下列说法错误的是( )
A. 丁香油酚中氢、氧元素的质量比为3∶8
B. 丁香油酚中氢元素的质量分数为12/164×100%
C. 丁香油酚分子中C、H、O的原子个数之比为5∶6∶l
D. 一个丁香油酚分子由10个C原子、12个H原子和1个O2分子构成
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】“三效催化转换器”可将汽车尾气中的有毒气体处理为无污染的气体,图-3为该反应的微观示意图。下列说法正确的是( )

图-3
A. 生成的丙和丁的分子个数比为1∶1
B. 反应前后,碳和氮的化合价发生了改变
C. 反应前后,元素的种类没有改变,原子的个数发生了变化
D. 乙和丙的元素组成相同,所以它们的化学性质相同
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室配制500g溶质质量分数为20%氢氧化钠溶液。
(1)用氢氧化钠固体和水配制溶液,需氢氧化钠固体的质量为____ g。
(2)按要求配制好溶液后,取其中100g溶液稀释成溶质质量分数为5%的氢氧化钠溶液,需加水的质量为____ g。
(3)过氧化钠是一种淡黄色固体,能与水发生化学反应,其反应的化学方程式为:2Na2O2+2H2O==4NaOH+O2↑。现将7.8g过氧化钠投入到100g 溶质质量分数为10%的氢氧化钠溶液中,完全反应。求反应后所得溶液的溶质质量分数。_________(写出计算过程,最后结果精确到0.1% 。)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某实验学校老师设计了下 图四种装置来帮助学生学习和理解质量守恒定律 请 你 起来参与他们的课题。
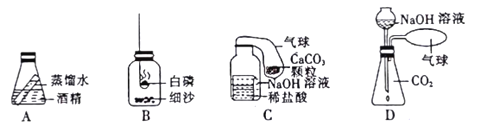
【 查阅资料】 ①白磷一般在40℃左右燃烧 而红磷要在 240℃左右才能燃烧, 白磷在空气中燃烧生成的白烟会污染空气;
②氢氧化钠与二氧化碳发生反应的化学方程式为:![]()
(1)根据质量守恒定律的定义,首先确定 A 装置不能验证质量守恒定律,理由是__________。
(2)根据实验装置的设计,又确定_________装置验证质量守恒定律会导致实验失败, 理由是_________。
(3)B装置可以验证质量守恒定律,为了使实验更环保,可采用__________________的方法,使瓶中的白磷燃烧 确保装置始终密闭。
(4)C装置中NaOH溶液的作用是_________,若把NaOH溶液全部清除,实验 (填" 能" 或“不能”) 成功,理由是__________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列所示的四个图像,能正确反映对应变化关系的是
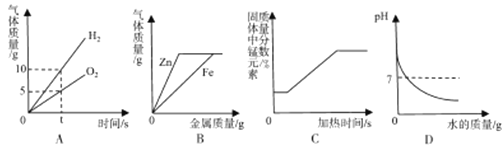
A.电解水
B.向两份完全相同的稀盐酸中分别加入锌粉和铁粉
C.加热一定质量的离锰酸钾
D.向一定量的氢氧化钠溶液中加水稀释
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com