
ΓΨΧβΡΩΓΩΙΐ―θΜ·«β»ή“Κ‘ΎMnO2Ής¥ΏΜ·ΦΝΒΡΧθΦΰœ¬Ρή―ΗΥΌΖ÷Ϋβ…ζ≥…O2ΚΆH2OΘ§Ζ÷“Κ¬©ΕΖΩ…“‘Ά®ΙΐΒςΫΎΜν»ϊΩΊ÷Τ“ΚΧεΒΡΒΈΦ”ΥΌΕ»ΓΘ»γœ¬ΆΦΘΚΜΊ¥πœ¬Ν–Έ ΧβΘΚ
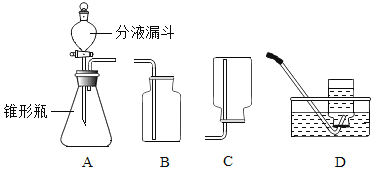
Θ®1Θ©Ζ÷“Κ¬©ΕΖ÷–”ΠΖ≈»κΒΡΈο÷ «___________Θ§ΉΕ–ΈΤΩ÷–”ΠΖ≈»κΒΡΈο÷ «______________ΓΘ
Θ®2Θ©–¥≥ωΗΟΖΫΖ®÷Τ»ΓO2ΒΡΜ·―ßΖ¥”ΠΖΫ≥Χ Ϋ________________________________ΘΜ“Σ ’Φ·“ΜΤΩ¥ΩΨΜΒΡO2Θ§”Π―Γ‘ώΉΑ÷Ο ___________Θ®ΧνΉ÷ΡΗΘ©ΓΘ
Θ®3Θ©Ρ≥Ά§―ß‘ΎΙέ≤λΒΫΉΕ–ΈΤΩΡΎ”–¥σΝΩΤχ≈ί ±Θ§ΩΣ Φ”ΟBΉΑ÷Ο ’Φ·O2Θ§Ιΐ“ΜΕΈ ±ΦδΚσ”Ο¥χΜπ–«ΒΡΡΨΧθ…λ»κΤΩΩΎΓΔΤΩ÷–ΓΔΤΩΒΉΘ§ΕΦΈ¥ΦϊΡΨΧθΗ¥»ΦΓΘΤδ‘≠“ρ «_______________________________ΓΘ
Θ®4Θ©–¥≥ω”ΟΗΟΉΑ÷Ο÷Τ»ΓΝμΆβ2÷÷ΤχΧεΒΡΜ·―ß ΫΘΚ___________ΚΆ___________ΓΘ
Θ®5Θ©»τ Β―ι ±”Ο¥ΥΖ®¥ζΧφKMnO4Φ”»»÷Τ»ΓO2Θ§”≈Βψ «_______________Θ®Χν±ύΚ≈Θ©ΓΘ
ΔΌ…ζ≥…Έο÷Μ”–―θΤχ ΔΎ≤Μ–ηΦ”»» Δέ–ηΦ”»»
Θ®6Θ©ΉΑ÷ΟA÷–Ζ¥”ΠΚήΨγΝ“Θ§Ψί¥ΥΧα≥ω Β―ιΑ≤»ΪΉΔ“β ¬œν «_________Θ®Χν±ύΚ≈Θ©ΓΘ
ΔΌΩΊ÷Τ“ΚΧεΒΡΒΈΦ”ΥΌΕ» ΔΎ”ΟΧεΜΐΫœ–ΓΒΡΉΕ–ΈΤΩ ΔέΦ”»»Ζ¥”ΠΈο
ΓΨ¥πΑΗΓΩΙΐ―θΜ·«β»ή“Κ Εΰ―θΜ·ΟΧ  D ΉΑ÷Ο¬©Τχ CO2 H2 ΔΎ ΔΌ
D ΉΑ÷Ο¬©Τχ CO2 H2 ΔΎ ΔΌ
ΓΨΫβΈωΓΩ
Θ®1Θ©Ζ÷“Κ¬©ΕΖ «Φ”»κ“ΚΧεΒΡ“«ΤςΘ§“ρ¥ΥάοΟφΦ”»κΒΡ «Ιΐ―θΜ·«β»ή“ΚΘΜΉΕ–ΈΤΩΡΎΖ≈»κΙΧΧεΘ§Υυ“‘ΈΣΕΰ―θΜ·ΟΧΘΜ
Ι ¥πΑΗΈΣΘΚΙΐ―θΜ·«β»ή“ΚΘΜΕΰ―θΜ·ΟΧΓΘ
Θ®2Θ©Ιΐ―θΜ·«β‘ΎΕΰ―θΜ·ΟΧΒΡ¥ΏΜ·Ής”Οœ¬Ζ÷Ϋβ…ζ≥…Υ°ΚΆ―θΤχΘ§Υυ“‘ΗΟΖ¥”ΠΒΡΜ·―ßΖΫ≥Χ ΫΈΣ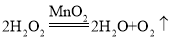 ΘΜ―θΤχ≤Μ“Ή»ή”ΎΥ°Θ§«“≤Μ”κΥ°Ζ¥”ΠΘ§Υυ“‘Ω…“‘≈≈Υ°Ζ® ’Φ·―θΤχΘ§¥ΥΖΫΖ®Ω…“‘”––ß±ήΟβΩ’ΤχΜλ»κΘ§‘λ≥…ΤχΧε≤Μ¥ΩΘ§Υυ“‘―Γ”Ο≈≈Υ°Ζ® ’Φ·ΒΡ―θΤχΫœΈΣ¥ΩΨΜΘ§“ρ¥Υ―Γ‘ώΒΡΉΑ÷ΟΈΣDΘΜ
ΘΜ―θΤχ≤Μ“Ή»ή”ΎΥ°Θ§«“≤Μ”κΥ°Ζ¥”ΠΘ§Υυ“‘Ω…“‘≈≈Υ°Ζ® ’Φ·―θΤχΘ§¥ΥΖΫΖ®Ω…“‘”––ß±ήΟβΩ’ΤχΜλ»κΘ§‘λ≥…ΤχΧε≤Μ¥ΩΘ§Υυ“‘―Γ”Ο≈≈Υ°Ζ® ’Φ·ΒΡ―θΤχΫœΈΣ¥ΩΨΜΘ§“ρ¥Υ―Γ‘ώΒΡΉΑ÷ΟΈΣDΘΜ
Ι ¥πΑΗΈΣΘΚ ΘΜDΓΘ
ΘΜDΓΘ
Θ®3Θ©ΡΨΧθΈ¥Η¥»ΦΥΒΟςΈ¥ ’Φ·ΒΫ―θΤχΘ§Ω…Ρή «ΉΑ÷Ο¬©ΤχΘ§‘λ≥…Φ·ΤχΤΩ÷–ΈόΖ® ’Φ·ΒΫ―θΤχΘ§¥χΜπ–«ΒΡΡΨΧθΒΡΖ≈»κΚσΨΆ≤ΜΜαΗ¥»ΦΘΜ
Ι ¥πΑΗΈΣΘΚΉΑ÷Ο¬©ΤχΓΘ
Θ®4Θ©ΗΟΉΑ÷ΟΈΣΙΧ“Κ≤ΜΦ”»»ΉΑ÷ΟΘ§ Β―ι “Ω…“‘”Ο¥σάμ ·”κœΓ―ΈΥαΖ¥”Π÷Τ»ΓΕΰ―θΜ·ΧΦΘ§ΜΙΩ…“‘”Ο–ΩΝΘ”κœΓΝρΥαΖ¥”Π…ζ≥…ΝρΥα–ΩΚΆ«βΤχΘΜ
Ι ¥πΑΗΈΣΘΚCO2ΘΜH2ΓΘ
Θ®5Θ©ΗΏΟΧΥαΦΊ÷Τ»Γ―θΤχΘ§–η“ΣΦ”»»Θ§‘ωΦ”ΝΥΡή‘¥œϊΚΡΘ§≤ΌΉς≤ΜΖΫ±ψΘ§Ιΐ―θΜ·«β»ή“Κ÷Τ»Γ―θΤχΘ§≤Μ–η“ΣΦ”»»Θ§≤ΌΉςΦρΒΞΘ§Ι ―ΓΔΎΘΜ
Ι ¥πΑΗΈΣΘΚΔΎΓΘ
Θ®6Θ©Ζ¥”ΠΨγΝ“ΥΒΟςΖ¥”ΠΥΌ¬ ΙΐΩλΘ§“ρ¥Υ–η“ΣΩΊ÷ΤΖ¥”ΠΥΌ¬ ΘΚ
ΔΌΓΔΩΊ÷ΤΒΈΦ”“ΚΧεΒΡΥΌΕ»Θ§Ω…“‘ΩΊ÷ΤΖ¥”ΠΈο≈®Ε»Θ§¥”ΕχΩΊ÷ΤΖ¥”ΠΥΌ¬ Θ§άϊ”ΟΑ≤»Ϊ≤ΌΉςΘ§ΔΌΖϊΚœΧβ“βΘΜ
ΔΎΓΔΧεΜΐΫœ–ΓΒΡΉΕ–ΈΤΩΘ§‘ωΦ”ΝΥ»ή“ΚΒΡ≈®Ε»Θ§Ά§ ±≤Μάϊ”Ύ»»ΝΩΒΡ…ΔΖΔΘ§ΕΦΜαΦ”ΩλΖ¥”ΠΥΌ¬ Θ§‘ωΦ”Ζ¥”ΠΒΡΨγΝ“≥…Θ§≤Μάϊ”ΎΑ≤»Ϊ≤ΌΉςΘ§ΔΎ≤ΜΖϊΚœΧβ“βΘΜ
ΔέΉΕ–ΈΤΩ≤ΜΡήΦ”»»Θ§Ά§ ±Φ”»»“≤ΜαΦ”ΥΌΖ¥”ΠΥΌ¬ Θ§‘ωΦ”Ζ¥”ΠΒΡΨγΝ“≥ΧΕ»Θ§≤Μάϊ”ΎΑ≤»Ϊ≤ΌΉςΔέ≤ΜΖϊΚœΧβ“βΘΜΙ ―ΓΔΌΘΜ
Ι ¥πΑΗΈΣΘΚΔΌΓΘ


 ΤΎΡ©≥ε¥Χ100Ζ÷¥¥–¬ΫπΨμΆξ»Ϊ ‘ΨμœΒΝ–¥πΑΗ
ΤΎΡ©≥ε¥Χ100Ζ÷¥¥–¬ΫπΨμΆξ»Ϊ ‘ΨμœΒΝ–¥πΑΗ
| ΡξΦΕ | ΗΏ÷–ΩΈ≥Χ | ΡξΦΕ | ≥θ÷–ΩΈ≥Χ |
| ΗΏ“Μ | ΗΏ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ“Μ | ≥θ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏΕΰ | ΗΏΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θΕΰ | ≥θΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏ»ΐ | ΗΏ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ»ΐ | ≥θ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
ΩΤΡΩΘΚ≥θ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ»γΆΦ « AΓΔBΓΔC »ΐ÷÷Έο÷ ΒΡ»ήΫβΕ»«ζœΏΘ§œ¬Ν––π ω≤Μ’ΐ»ΖΒΡ «
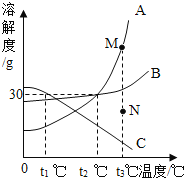
A.Β±Έ¬Ε»ΈΣ t3Γφ ±Θ§Έο÷ »ήΫβΕ»ΙΊœΒ « A>B>C
B.ΫΪ AΓΔBΓΔC ΒΡ±ΞΚΆ»ή“Κ¥” t3ΓφΫΒΒΫ t2ΓφΘ§»ή“Κ÷–Ψυ”–ΙΧΧεΈω≥ω
C.»τ“ΣΫΪNΒψΒΡA»ή“ΚΉΣ±δΈΣ M ΒψΒΡA»ή“ΚΘ§ Ω…‘ΎΚψΈ¬ΧθΦΰœ¬Φ”»κAΈο÷
D.t1Γφ ± 65gC ΒΡ±ΞΚΆ»ή“Κ÷–Κ§”– C Έο÷ 15g
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚ≥θ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩAΓΪHΕΦ «≥θ÷–Μ·―ß≥ΘΦϊΒΡΈο÷ Θ§ΥϋΟ«ΒΡΉΣΜ·ΙΊœΒ»γΆΦΥυ ΨΓΘAΓΔBΨυΈΣΚΎ…ΪΖέΡ©ΘΜDΓΔFΨυΈΣΚλ…ΪΙΧΧεΘ§«“DΈΣΒΞ÷ Θ§FΈΣ―θΜ·ΈοΘΜCΡή Ι≥Έ«ε ·Μ“Υ°±δΜκΉ«ΓΘ«κΜΊ¥πΘΚ
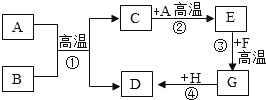
Θ®1Θ©Ζ¥”ΠΔΌΒΡΜ·―ßΖΫ≥Χ ΫΈΣ______________________Θ§ΗΟΖ¥”ΠΒΡœ÷œσΈΣ_________ΘΜ
Θ®2Θ©Ζ¥”ΠΔήΒΡΜ·―ßΖΫ≥Χ ΫΈΣ________________________________________ΘΜ
Θ®3Θ©–¥≥ωEΒΡ“Μ÷÷”ΟΆΨ______________ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚ≥θ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΫΪ“ΜΕ®ΝΩΒΡ«β―θΜ·ΡΤ»ή“Κ”κœΓ―ΈΥαΜλΚœΘ§Εΰ’Ώ«ΓΚΟΆξ»ΪΖ¥”ΠΒΡΈΔΙέ Ψ“βΆΦ»γœ¬ΓΘœ¬Ν–ΥΒΖ®≤Μ’ΐ»ΖΒΡ «

A. Ζ¥”Π«ΑΚσ“θΓΔ―τάκΉ”ΒΡΉή ΐΡΩ≤Μ±δ
B. Ζ¥”Π«ΑΚσ»ή“ΚΒΡΉή÷ ΝΩ≤Μ±δ
C. Ζ¥”ΠΚσ»ή“Κ≥ ÷––‘
D. Ζ¥”Π«ΑΚσ‘ΣΥΊ÷÷άύ≤Μ±δ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚ≥θ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΧΦΥαΡΤΙψΖΚ”Ο”Ύ‘λ÷ΫΓΔΖΡ÷·ΓΔ÷ΤΗοΒ»ΙΛ“ΒΘ§ «“Μ÷÷÷Ί“ΣΒΡΜ·ΙΛ‘≠ΝœΓΘΈ“ΙζΚνΒ¬ΑώΖΔΟςΝΥΫΪ÷ΤΦν”κ÷ΤΑ±ΫαΚœΤπά¥ΒΡΝΣΚœ÷ΤΦνΖ®Θ§ΈΣΧΦΥαΡΤΒΡΙΛ“ΒΜ·…ζ≤ζΉς≥ωΝΥΨό¥σΙ±œΉΓΘ
Θ®≤ι‘ΡΉ ΝœΘ©Κν œ÷ΤΦνΖ®÷–÷ς“ΣΖ¥”ΠΘΚ
Δώ.NaCl+NH3+CO2+H2O®TNaHCO3Γΐ+NH4Cl
Δρ.2NaHCO3![]() Na2CO3+H2O+CO2Γϋ
Na2CO3+H2O+CO2Γϋ
Θ® Β―ιΧΫΨΩΘ©–ΓΟς“‘¥÷―Έ≈δ÷Τ±ΞΚΆ ≥―ΈΥ°Θ§≤Δ≤…”Οœ¬Ν–ΉΑ÷ΟΡΘΡβ÷Τ±ΗΧΦΥα«βΡΤΘ§ΫχΕχ÷ΤΒΟΧΦΥαΡΤΓΘ
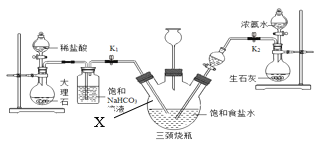
Β―ι≤ΌΉς»γœ¬ΘΚ
ΔΌΙΊ±’K1Θ§¥ρΩΣK2Ά®»κNH3Θ§ΒςΫΎΤχΝςΥΌ¬ Θ§¥ΐΤδΈ»Ε®ΚσΘ§¥ρΩΣK1Ά®»κCO2ΘΜ
ΔΎ¥ΐ»ΐΨ±…’ΤΩΡΎ≥ωœ÷ΫœΕύΙΧΧε ±Θ§ΙΊ±’K2ΆΘ÷ΙΆ®NH3Θ§“ΜΕΈ ±ΦδΚσΘ§ΙΊ±’K1ΆΘ÷ΙΆ®CO2ΘΜ
ΔέΫΪ»ΐΨ±…’ΤΩΡΎΒΡΖ¥”ΠΜλΚœΈοΙΐ¬ΥΓΔœ¥Β”ΓΔΒΆΈ¬Η…‘οΘ§≤ΔΫΪΥυΒΟΙΧΧε÷Ο”Ύ≥®ΩΎ»ίΤς÷–Φ”»»Θ§Φ«¬Φ Θ”ύΙΧΧε÷ ΝΩΓΘ«κΜΊ¥πœ¬Ν–Έ ΧβΘΚ
Φ”»» ±Φδ/min | t0 | t1 | t2 | t3 | t4 | t5 |
Θ”ύΙΧΧε÷ ΝΩ/g | Έ¥Φ«¬Φ | 15.3 | 13.7 | 11.9 | 10.6 | 10.6 |
Θ®1Θ©¥÷―Έ÷–≥ΐΝΥΚ§”–Ρύ…≥Β»≤Μ»ή–‘‘”÷ Θ§ΜΙΚ§”–…ΌΝΩΒΡMgCl2Β»ΓΘ»τ“Σ≥ΐ»Ξ¥÷―Έ÷–ΒΡMgCl2Θ§Ω…Φ”»κΙΐΝΩΒΡNaOH»ή“ΚΘ§–¥≥ωΕ‘”ΠΒΡΜ·―ßΖΫ≥Χ Ϋ_____Θ§‘ΌΙΐ¬ΥΘ§»ΜΚσœρ¬Υ“Κ÷–Φ”»κ ΝΩ_____Θ§ΒΟΒΫ¬»Μ·ΡΤ»ή“ΚΓΘ
Θ®2Θ©±ΞΚΆNaHCO3»ή“ΚΒΡΉς”Ο «≥ΐ»ΞCO2÷–Μλ”–ΒΡHClΘ§Ζ¥”ΠΒΡΜ·―ßΖΫ≥Χ ΫΈΣ_____ΓΘ…œ ω Β―ιΉΑ÷ΟΆΦ÷–“«ΤςXΟϊ≥Τ_____ΓΘ
Θ®3Θ©»ΐΨ±…’ΤΩ…œΝ§Ϋ”ΒΡ≥ΛΨ±¬©ΕΖΒΡ÷ς“ΣΉς”Ο «_____Θ§”–Ά§―ß»œΈΣ”ΠΗΟ‘Ύ≥ΛΨ±¬©ΕΖΡΎΖ≈÷Ο“ΜΆ≈’Κ”–Υα“ΚΒΡΟόΜ®Θ§άμ”… «_____ΘΜΙΊ±’K2ΆΘ÷ΙΆ®NH3ΚσΘ§ΜΙ“ΣΦΧ–χΆ®“ΜΕΈ ±ΦδCO2Θ§ΤδΡΩΒΡ «_____ΓΘ
Θ®4Θ©ΗυΨί Β―ιΦ«¬ΦΘ§ΦΤΥψt2 ±NaHCO3ΙΧΧεΒΡΖ÷Ϋβ¬ Θ®“―Ζ÷ΫβΒΡNaHCO3÷ ΝΩ”κΦ”»»«Α‘≠NaHCO3÷ ΝΩΒΡ±»÷ΒΘ©Θ§«κ–¥≥ωΦΤΥψΙΐ≥Χ_____ΓΘ
Θ®ΆΊ’Ι―”…λΘ©–ΓΜΣ…ηΦΤ»γΆΦΒΡ Β―ιΉΑ÷Ο≤βΕ®Ρ≥¥ΩΦν―υΤΖΘ®Κ§…ΌΝΩ‘”÷ NaClΘ©÷–ΧΦΥαΡΤΒΡ÷ ΝΩΖ÷ ΐΘΚ»Γ“ΜΕ®ΝΩΒΡ―υΤΖ”κΉψΝΩœΓΝρΥαΖ¥”ΠΘ§Ά®Ιΐ≈≈±ΞΚΆΧΦΥα«βΡΤ»ή“Κ≤βΕ®…ζ≥…CO2ΒΡΧεΜΐΘ§ΦΤΥψ―υΤΖ÷–ΧΦΥαΡΤΒΡ÷ ΝΩΖ÷ ΐΓΘ

Θ®“―÷Σ≥ΘΈ¬≥Θ―Ιœ¬CO2ΒΡΟήΕ» «1.977g/LΘ©
Θ®1Θ©»γΙϊ―υΤΖ÷ ΝΩΈΣ5.3gΘ§‘ρ Β―ι÷–―Γ”ΟΒΡΝΩΤχΙήΙφΗώΉνΚœ ΒΡ «_____Θ®ΧνΉ÷ΡΗΘ©ΓΘ
A 500mL B 1000mL C 1500mL D 2000mL
Θ®2Θ©»τ Β―ι÷–≤βΒΟΧΦΥαΡΤ÷ ΝΩΖ÷ ΐΤΪ–ΓΘ§œ¬Ν–Ω…ΡήΒΡ‘≠“ρ «_____ΓΘ
aΘ°ΉΑ÷Ο¬©Τχ
bΘ°ΕΝ»Γ ΐΨί ±ΝΩΤχΙήΒΡ“ΚΟφΒΆ”ΎΥ°ΉΦΙήΒΡ“ΚΟφ
cΘ°Ζ¥”ΠΫα χΚσ…’ΤΩ÷–”–CO2≤–Ντ
dΘ°ΕΝ»Γ ΐΨί ±―ω ”ΕΝ ΐ
eΘ°œΓΝρΥαΦ”»κ…’ΤΩ’ΦΨίΧεΜΐ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚ≥θ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΗυΨίœ¬±μ–≈œΔΘ§œύΙΊΥΒΖ®’ΐ»ΖΒΡ «Θ® Θ©

AΘ°20Γφ ±Θ§NaCl ΒΡ»ή“ΚΕ»ΈΣ 36.0
BΘ°40Γφ ±Θ§KCl ±ΞΚΆ»ή“ΚΒΡ»ή÷ ÷ ΝΩΖ÷ ΐΈΣ 40%
CΘ°40Γφ ±Θ§œρ 100g Υ°÷–Φ”»κ 50gNH4Cl ≥δΖ÷»ήΫβΘ§»ή“Κ÷ ΝΩΈΣ 145.8g
DΘ°60Γφ ±ΫΒΈ¬ΒΫ 20Γφ ±Θ§KNO3 ΚΆ KCl ΒΡ±ΞΚΆ»ή“ΚΈω≥ωΨßΧεΫœΕύΒΡ « KNO3
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚ≥θ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ»Υάύ…ζΜνάκ≤ΜΩΣΫπ τΉ ‘¥ΓΘ
Θ®1Θ©ΚΗΈΐ”κΤδΉι≥…ΥϋΒΡ¥ΩΫπ τœύ±»ΨΏ”–_____________ΒΡΧΊ–‘Θ§Ω…”Οά¥ΚΗΫ”ΒγΉ”‘ΣΦΰΓΘ
Θ®2Θ©Ή‘––≥Β±μΟφ≈γΤα≤ΜΫωΟάΙέΘ§Εχ«“Ω…”––ßΖά÷ΙΧζ”κ_____________Ϋ”¥ΞΕχ…ζ–βΓΘ
Θ®3Θ©ΙΛ“Β…œ”Ο“Μ―θΜ·ΧΦΚΆ¥≈ΧζΩσ ·ά¥ΝΕΧζΒΡΜ·―ßΖΫ≥Χ ΫΈΣ______________ΓΘ
Θ®4Θ©œρœθΥαΆ≠ΚΆœθΥα“χΒΡΜλΚœ»ή“Κ÷–Φ”»κ“ΜΕ®ΝΩΒΡ–ΩΖέΘ§≥δΖ÷Ζ¥”ΠΚσΙΐ¬ΥΒΟΒΫ¬Υ‘ϋΚΆΈό…Ϊ¬Υ“ΚΘ§‘Ύ¬Υ“Κ÷–ΒΡ»ή÷ ΈΣ________________Θ§¬Υ‘ϋ÷–“ΜΕ®Κ§____________ΓΘ «κ–¥≥ω“ΜΧθ”–ΙΊΒΡΜ·―ßΖ¥”ΠΖΫ≥Χ Ϋ______________ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚ≥θ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩAΓΔBΓΔCΓΔDΓΔEΓΔFΈΣ≥θ÷–≥ΘΦϊΒΡΝυ÷÷Έο÷ Θ§”ΟΓΑ“ΜΓ±±μ ΨΝΫ÷÷Έο÷ ΦδΡήΖΔ…ζΜ·―ßΖ¥”ΠΘ§”ΟΓΑΓζΓ±±μ Ψ“Μ÷÷Έο÷ Ω…“‘ΉΣΜ·≥…Νμ“Μ÷÷Έο÷ (≤ΩΖ÷Ζ¥”ΠΈοΜρ…ζ≥…ΈοΦΑΖ¥”ΠΧθΦΰ“―¬‘»Ξ)ΓΘ“―÷ΣAΓΔCΓΔDΓΔEΖ÷±π τ”Ύ≤ΜΆ§άύ±πΒΡΥΡ÷÷Έο÷ Θ§C»ή“ΚΈΣΈό…ΪΘ§FΈΣΑΉ…ΪΙΧΧεΘ§D»ή“Κ”κ≈δ÷Τ≤®ΕϊΕύ“ΚΒΡ“Μ÷÷Έο÷ Ζ¥”ΠΜα…ζ≥…ΝΫ÷÷≥ΝΒμΓΘ
Θ®1Θ©–¥≥ωœ¬Ν–Έο÷ ΒΡΜ·―ß ΫΘΚA_________ΘΜB___________ΘΜE___________ΘΜF___________ΓΘ
Θ®2Θ©–¥≥ωCΉΣΜ·≥…BΒΡΜ·―ßΖΫ≥Χ ΫΘΚ____________ΓΘ
Θ®3Θ©–¥≥ωC»ή“Κ÷–ΒΈΦ”D»ή“Κ÷ΝΙΐΝΩΒΡ Β―ιœ÷œσΘΚ_______________ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚ≥θ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
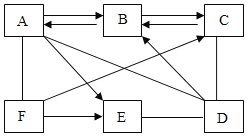
ΓΨΧβΡΩΓΩ“―÷ΣAΓΪGΨυ «≥θ÷–Μ·―ß≥ΘΦϊΒΡΈο÷ ΓΘA”κBΒΡΖ¥”Π‘ΎΙΛ“Β…œΩ…”Ο”ΎΗΏ¬·ΝΕΧζΘ§BΈΣΚλΉΊ…ΪΙΧΧε―θΜ·ΈοΘ§E÷–Κ§”–ΝΫ÷÷‘ΣΥΊΘ§F‘Ύ≈©“Β…œΩ…”Οά¥ΗΡΝΦΥα–‘ΆΝ»άΓΘΥϋΟ«ΒΡœύΜΞΙΊœΒ»γΆΦΥυ ΨΘ®ΓΑ©¹Γ±±μ ΨΝΫ÷÷Έο÷ ΡήΖΔ…ζΜ·―ßΖ¥”ΠΘ§ΓΑΓζΓ±±μ Ψ“Μ÷÷Έο÷ ΡήΉΣΜ·ΈΣΝμ“Μ÷÷Έο÷ Θ§≤ΩΖ÷Ζ¥”ΠΈοΓΔ…ζ≥…ΈοΦΑΖ¥”ΠΧθΦΰ“―¬‘»ΞΘ©ΓΘ«κΜΊ¥πΘΚ
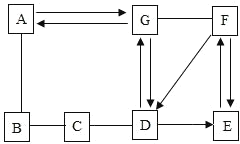
Θ®1Θ©A©¹BΒΡΜ·―ßΖ¥”ΠΖΫ≥Χ ΫΈΣ____________ΓΘ
Θ®2Θ©–¥≥ωFΒΡ“Μ÷÷”ΟΆΨΘΚ_____________ΓΘ
Θ®3Θ©B-CΒΡΜυ±ΨΖ¥”Πάύ–Ά «_____________ΓΘ
Θ®4Θ©CΒΡΈο÷ άύ±π «_____________Θ®ΧνΓΑ―θΜ·ΈοΓ±ΓΔΓΑΥαΓ±ΓΔΓΑΦνΓ±ΜρΓΑ―ΈΓ±Θ©ΓΘ
Θ®5Θ©GΓζAΒΡΜ·―ßΖ¥”ΠΖΫ≥Χ ΫΈΣ_____________ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΑΌΕ»÷¬–≈ - ΝΖœΑ≤αΝ–±μ - ‘ΧβΝ–±μ
Κΰ±± ΓΜΞΝΣΆχΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΤΫΧ® | Άχ…œ”–ΚΠ–≈œΔΨΌ±®Ή®«χ | Βγ–≈’©Τ≠ΨΌ±®Ή®«χ | …φάζ Ζ–ιΈό÷ς“ε”–ΚΠ–≈œΔΨΌ±®Ή®«χ | …φΤσ«÷»®ΨΌ±®Ή®«χ
ΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΒγΜΑΘΚ027-86699610 ΨΌ±®” œδΘΚ58377363@163.com