
| 混合物的质量-原混合物中碳酸钠的质量 |
| 混合物的质量 |
| 混合物的质量-原混合物中碳酸钠的质量 |
| 混合物的质量 |
| 106 |
| x |
| 44 |
| 2.2g |
| 26.5g-5.3g |
| 26.5g |
| (53g-10.6g) |
| 53g |


科目:初中化学 来源: 题型:
 元素周期表是学习化学的重要工具,如图是元素周期表中的一格.从该图中,获取的下列信息中错误的是( )
元素周期表是学习化学的重要工具,如图是元素周期表中的一格.从该图中,获取的下列信息中错误的是( )| A、该元素的名称是镁 |
| B、该元素的原子序数是12 |
| C、该元素的原子核内有12个质子 |
| D、该元素原子的质量是24.31g |
查看答案和解析>>
科目:初中化学 来源: 题型:
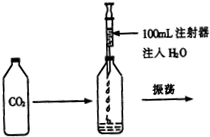 校化学课外小组的同学,利用塑料瓶(质软)设计了如图所示的实验.请你根据生活经验及所学的知识,结合实验回答下列问题:
校化学课外小组的同学,利用塑料瓶(质软)设计了如图所示的实验.请你根据生活经验及所学的知识,结合实验回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:
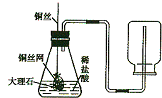 李丽同学设计了实验室制取CO2装置(如图所示),装置中出现了一个错误,你的纠正方法是
李丽同学设计了实验室制取CO2装置(如图所示),装置中出现了一个错误,你的纠正方法是查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:
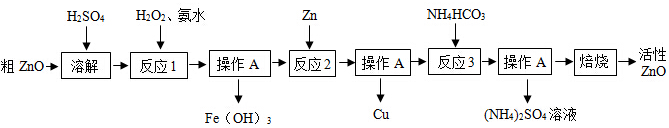
| 物质 | Fe(OH)2 | Fe(OH)3 | Zn(OH)2 | Cu(OH)2 |
| 开始沉淀时pH | 6.34 | 1.48 | 6.2 | 5.2 |
| 完全沉淀时pH | 9.7 | 3.2 | 8.0 | 6.4 |
| Fe(OH)2是一种絮状沉淀,不易除去,处理时常将其转化为Fe(OH)3而除去. | ||||
| ||
| ||
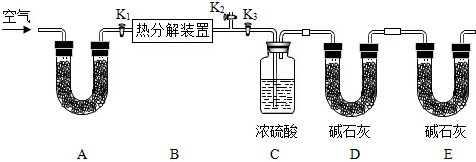
| 装置C的质量(/g) | 装置D的质量(/g) | |
| 实验前 | 198.4 | 235.7 |
| 实验后 | 209.2 | 244.5 |
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
| 稀盐酸的用量 | 第一次加入5g | 第二次加入5g | 第三次加入5g | 第四次加人5g |
| 剩余固体的质量 | 6g | 4g | 2g | 2g |
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com