
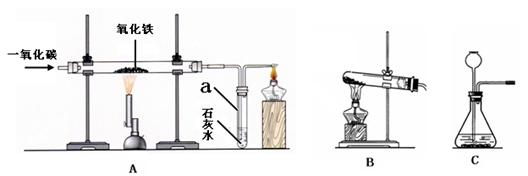
 3CO2+2Fe
3CO2+2Fe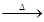 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑ 3CO2+2Fe。
3CO2+2Fe。

科目:初中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
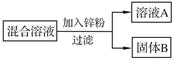
| 实验步骤 | 现象 | 结论及反应原理 |
| 取少量B,滴加 | 有气泡产生 | 结论: 化学方程式: |
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
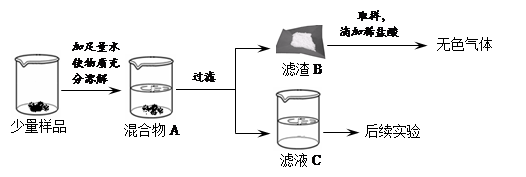
| 实验操作 | 实验现象 | 实验结论 |
| _____ | _____ | 猜想③正确 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
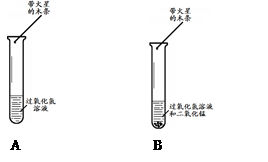

 时间/s 时间/s试剂 压强/KPa | 0 | 60 | 120 | 180 | 240 | 300 |
| 20mL 5%的过氧化氢溶液 | 101.86 | 102.99 | 103.42 | 103.67 | 103.99 | 104.00 |
| 加入氯化铁溶液 | 102.21 | 105.35 | 115.40 | 129.69 | 145.52 | 163.99 |
| 加入氯化铜溶液 | 101.50 | 102.73 | 107.53 | 114.78 | 122.49 | 130.39 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
| 实验操作 | 实验现象 | 实验结论 |
| 取少量固体剩余物于试管中,向其中加入足量的稀盐酸。 | (1)固体部分溶解,溶液为无色。 | 假设①成立。 |
| (2) 。 | 假设②成立。 | |
| (3) 。 | 假设③成立。 |
| 实验组别 | I | II | III | IV | V |
| 药 品 | Al | Fe | Ag | Al | Cu |
| CuO | CuO | CuO | Fe2O3 | Fe2O3 | |
| 相同条件下是否反应 | 是 | 是 | 否 | 是 | 否 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:填空题
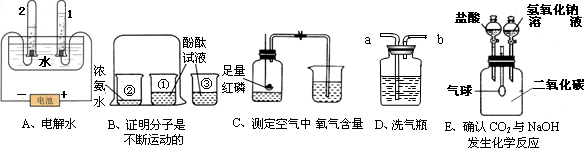
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com