
【题目】在密闭容器中,将盛有丙烯(C3H6)和氧气的混合气体点燃使其充分反应,丙烯全部转化为CO、CO2和H2O,待容器恢复至室温,测得反应前后容器内混合气体中碳元素的质量分数之比为50:77。.则参加反应的H2O和O2的质量比为_____;其反应的化学方程式是_____。
【答案】27:56 
【解析】
丙烯与氧气充分反应,丙烯全部转化成一氧化碳、二氧化碳和水。说明丙烯中的氢元素全部转化成水中的氢元素;有一氧化碳生成物说明氧气已被完全消耗完。所以反应前的气体就是丙烯与氧气的混合物,反应后的气体是一氧化碳和二氧化碳的混合物,恢复至室温后,水已变成液体不在气体混合物中了。所以反应前后混合气体中的碳元素质量分数提升,是因为有水产生,根据质量守恒定律,反应后的气体质量减少。
设反应前丙烯质量为x,氧气质量为y,丙烯内碳元素的质量为:![]() =
=![]() 。则丙烯内氢元素的质量为:
。则丙烯内氢元素的质量为:![]() 。反应后,丙烯内氢元素全部转化为水,所以反应后水的质量为:
。反应后,丙烯内氢元素全部转化为水,所以反应后水的质量为: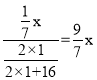 。所以反应后混合气体的质量为:x+y-
。所以反应后混合气体的质量为:x+y-![]() x。根据反应前后混合气体中碳元素的质量分数比得出:
x。根据反应前后混合气体中碳元素的质量分数比得出: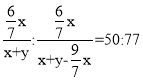 ,解得x:y=3:8,即x=
,解得x:y=3:8,即x=![]() 。参加反应的水和氧气的质量比:H2O:O2=
。参加反应的水和氧气的质量比:H2O:O2=![]() =27:56。从上述计算可知,反应前丙烯与氧气的质量比是3:8,而相对分子质量比=42:32=21:16。所以丙烯分子和氧气分子的数量比为:
=27:56。从上述计算可知,反应前丙烯与氧气的质量比是3:8,而相对分子质量比=42:32=21:16。所以丙烯分子和氧气分子的数量比为:![]() =2:7。所以化学反应方程式为:
=2:7。所以化学反应方程式为: 。故答案为:27:56、
。故答案为:27:56、 。
。


 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案科目:初中化学 来源: 题型:
【题目】下图是过氧化氢在一定条件下发生分解反应的微观模拟图,请回答下列问题:
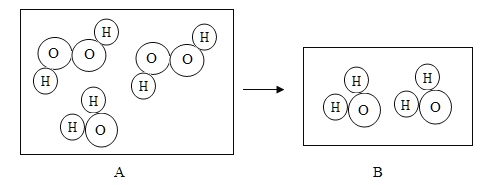
(1)在B图中将相关粒子图形补充完整_____。
(2)此反应前后未发生改变的粒子有_____(填微粒名称)。
(3)写出比一个水分子多1个质子的离子符号_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我国古代的物质文明华夏民族在认识、改造和应用物质方面有着辉煌的历史。
①东晋《抱扑子》中记载:“以曾青涂铁,铁赤色如铜”(“曾青”即硫酸铜溶液)。
②元代《庚道集》中记载:“点铜成银”(即单质铜与砷熔合形成银白色的合金)。
请运用你学过的化学知识回答下列问题:
(1)①中发生变化的化学方程式为_____________;②中的“银”与纯铜相比,物理特性的变化是______________________________。
(2)兰州中山铁桥历尽沧桑,百年不倒。工程师发现大桥铆合处簇新如初,说明百年来铆合处铁没有与_________反应而造成锈蚀。
(3)金属矿物储量有限,而且不能再生,保护金属资源的有效途径除防止金属的锈蚀,还有_________(写一条即可)等。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某种矿石由氧化镁、氧化铁、氧化铜和二氧化硅组成,用它制备氢氧化镁的流程示意图如图所示(已知:二氧化硅不溶于水也不与稀盐酸反应)。
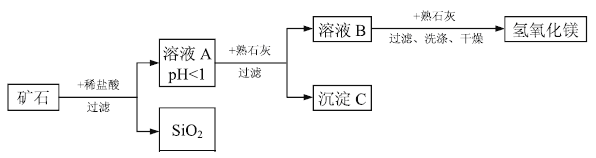
请回答下列问题:
(1)溶液A中共含有____种阳离子;写出矿石中的任意一种金属氧化物与稀盐酸反应的化学方程式:____________(只写一个)。
(2)在溶液A中加入熟石灰调节溶液的pH,可以使溶液中的金属阳离子逐步转化为沉淀。该实验条件下,使金属阳离子沉淀的相关pH数据见下表。为保证产品纯度、减少产品损失,并便于操作,所得溶液B的pH的取值范围为________。
氢氧化物 | Fe(OH)3 | Cu(OH)2 | Mg(OH)2 |
开始沉淀的pH | 1.5 | 4.2 | 8.6 |
完全沉淀的pH | 3.2 | 6.7 | 11.1 |
(3)写出溶液B中加入熟石灰发生的化学反应方程式:___________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学活动小组以“酸、碱、盐的性质”为主题进行探究性学习,请你与他们一起解决下列问题。
(1)下面是该组同学在探究酸、碱、盐的性质时对某无色溶液所含溶质的记录,其中合理的是_____(填字母代号)。
a.氢氧化钠、碳酸钠、氯化钠
b.硝酸钾、氯化钠、氯化铁
c.氢氧化钙、碳酸钠、氯化钠
d.氢氧化钠、氯化钠、氯化氢
(2)我国化学家侯德榜发明了联合制碱法,所制得的“碱”的化学式是_____。
(3)通过查阅资料可知,过氧化钠固体(Na2O2)与水反应生成氢氧化钠和氧气,写出该反应的化学方程式_____。
(4)在学习NaOH性质时知道,氢氧化钠溶液久置在空气中易变质,如图是敞口放置的氢氧化钠溶液,康康同学想知道该溶液是否变质或变质的程度。
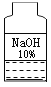
①写出氢氧化钠变质的原因。_____(用文字描述)
②请设计实验验证该溶液的成分。_____(简要写出实验步骤、现象和结论)
③如何除去少量变质的NaOH溶液中的杂质,用化学方程式表示_____。
(5)取部分变质的氢氧化钠溶液50g,向其中加入溶质质量分数为9.8%的稀硫酸50g.恰好完全反应得到中性溶液,计算反应后溶液中溶质的质量_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在实验室中,同学们用如图装置制取纯净干燥的CO2。
(查阅资料)饱和碳酸氢钠溶液可以吸收HCl而不吸收CO2
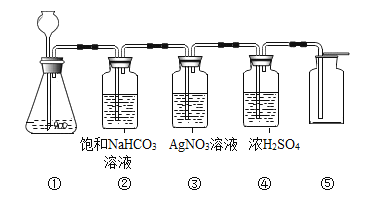
(1)实验室用石灰石和稀盐酸制取二氧化碳,该二氧化碳气体含有的杂质是氯化氢气体和__________(填物质名称)。
(2)若缺少装置②,则装置③中可能会出现白色浑浊,其原因是__________(用化学方程式表示)。
(3)若将装置④做在装置③前面,产生的后果是__________。
(4)在装置⑤中是用瓶口朝上方法收集二氧化碳气体,其原因是_______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】氢氧化钴受热易分解,能与酸性溶液反应,可作涂料和清漆的干燥剂,制备方法为:![]() 下列判断正确的是( )
下列判断正确的是( )
A. 金属活动性顺序中钴在铜之后B. 氢氧化钴可溶解于水
C. ![]() 为置换反应,
为置换反应,![]() 为复分解反应D. 氢氧化钴可干燥HCl
为复分解反应D. 氢氧化钴可干燥HCl
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】白磷、红磷都是可燃物,都可以在一定条件下燃烧。以下是利用它们的可燃性进行的三个实验,请分别回答问题。
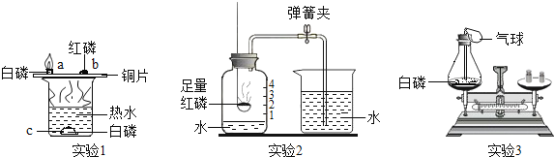
(1)通过实验1可以探究燃烧的条件。烧杯中放有热水,a、b、c处分别放有药品,实验中只有a处的白磷燃烧。a与c对比;a与b对比,说明燃烧需要的条件是可燃物与氧气接触和__________,白磷燃烧的化学方程式为____________。
(2)通过实验2可以测定_____________。待集气瓶中的红磷熄灭,冷却后打开弹簧夹,当观察到_________________________________的现象时,可达到该实验目的。
(3)通过实验3可以验证质量守恒定律。实验前将白磷放入锥形瓶中,称量装置的总质量,引燃白磷,待反应后再称量装置总质量,发现托盘天平指针_______________(填“向右偏转”,“向左偏转”,“不偏转”)。整个实验过程中气球会出现的现象是________________。
综合分析上述三个实验,以下说法正确的是________。(填①~⑥序号)
①实验1中的热水只起隔绝空气的作用
②实验2中红磷可以换成木炭
③实验2若未达到实验目的,可能是由于装置气密性不好
④实验3中的气球起到了平衡瓶内外气体压强的作用
⑤实验3中的气球作用是收集产生的气体
⑥实验3锥形瓶内事先放少量细沙的作用是防止瓶底炸裂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com