
分析 稀盐酸与氢氧化钠溶液反应生成氯化钠和水,由参加反应的稀盐酸的质量、溶质的质量分数,由反应的化学方程式列式计算出参加反应的氢氧化钠的质量、生成氯化钠的质量,进而计算出所得溶液中溶质的质量分数.
解答 解:溶质质量分数为7.3%稀盐酸的质量为10g中含溶质的质量为10g×7.3%=0.73g.
设参加反应的氢氧化钠的质量为x,生成氯化钠的质量为y,
HCl+NaOH═NaCl+H2O
36.5 40 58.5
0.73g x y
(1)$\frac{36.5}{40}=\frac{0.73g}{x}$ x=0.8g
(2)$\frac{36.5}{58.5}=\frac{0.73g}{y}$ y=1.17g
完全反应时所得溶液中溶质的质量分数为$\frac{1.17g}{10g+10g}×$100%=5.85%.
答:(1)此氢氧化钠溶液中溶质的质量为0.8g;(2)完全反应时所得溶液中溶质的质量分数为5.85%.
点评 本题难度不大,掌握利用化学方程式与溶质质量分数的综合计算即可正确解答本题,解题时要注意解题的规范性.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
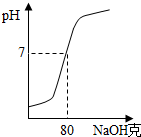 为测定某氢氧化钠溶液的质量分数,现在200克18.25%的稀盐酸中加入此氢氧化钠溶液,所得溶液的pH值与加入氢氧化钠溶液的质量之间的关系如图.
为测定某氢氧化钠溶液的质量分数,现在200克18.25%的稀盐酸中加入此氢氧化钠溶液,所得溶液的pH值与加入氢氧化钠溶液的质量之间的关系如图.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | Fe+H2SO4═FeSO4+H2↑ | B. | BaCl2+2NaN03═Ba(N03)2+2NaCl | ||
| C. | Na2O+H2O═2NaOH | D. | Ca(OH)2+2HN03═Ca(N03)2+2H2O |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 野炊过程实际上是运用科学知识分析、解决问题的过程,该项活动过程中涉及许多科学知识的运用.某次野炊活动中,同学们携带了铁锅、豆腐、牛肉、面条、西红柿、食用油、食盐、味精、食醋、洗涤用碱(有效成份为碳酸钠)等物品.
野炊过程实际上是运用科学知识分析、解决问题的过程,该项活动过程中涉及许多科学知识的运用.某次野炊活动中,同学们携带了铁锅、豆腐、牛肉、面条、西红柿、食用油、食盐、味精、食醋、洗涤用碱(有效成份为碳酸钠)等物品.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com