
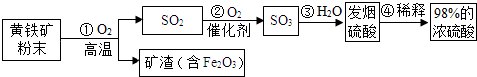
分析 (1)a、将矿石粉碎,能增大反应物的接触面积;
b、过量空气中能带来较多的氧气,能提高SO2的转化率;
c、根据催化剂的特点分析;
d、根据矿渣中含有氧化铁分析.
(2)根据稀释浓硫酸的方法回答;
(3)根据反应写出反应的化学方程式.
(4)根据氧化铁与硫酸反应的方程式,由硫酸的质量求出氧化铁的质量,再求出氧化铁的质量分数.
解答 解:(1)a.将黄铁矿粉碎的目的,是增大反应物的接触面积,故a说法正确;
b.过量空气带来较多的氧气,能提高SO2的转化率,故b正确;
c.使用催化剂能改变反应的速率等,不能提高SO3的产量,故c错误;
d.排出的矿渣中含有氧化铁,可供炼铁,故d正确;
(2)稀释浓硫酸时:将浓硫酸沿烧杯内壁慢慢注入水中,并用玻璃棒不断搅拌.
(3)过程②中二氧化硫和氧气在催化剂的作用下生成了三氧化硫,化学方程式为2SO2+O2$\frac{\underline{\;催化剂\;}}{\;}$2SO3;
(4)150g9.8%的稀硫酸中含H2SO4的质量是:150g×9.8%=14.7g
设氧化铁的质量为x
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
160 294
x 14.7g
$\frac{160}{294}=\frac{x}{14.7g}$ 解得:x=8g
该矿渣样品中Fe2O3的质量分数为:$\frac{8g}{10g}×100%$=80%.
故答为:(1)C;(2)将浓硫酸沿烧杯内壁慢慢注入水中,并用玻璃棒不断搅拌;(3)2SO2+O2$\frac{\underline{\;催化剂\;}}{\;}$2SO3;(4)该矿渣样品中氧化铁的质量分数为80%.
点评 解答本题的关键是知道反应物接触面积越大,反应越剧烈;熟悉方程式的书写注意事项;知道浓硫酸的稀释方法等知识.


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 80% | B. | 37.5% | C. | 75% | D. | 24% |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:填空题
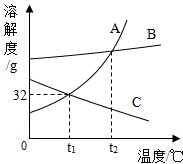 如图是A、B、C三种固体物质溶解度曲线.
如图是A、B、C三种固体物质溶解度曲线.查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com